EB21880 | СПАДИЛО
ЕГЭ▿повышенный уровень сложности▿РЕШУ ЕГЭ(21880)
Установите соответствие между характеристикой среды обитания и средой, соответствующей данной характеристике: к каждой позиции, данной в первом столбце, подберите соответствующую позицию из второго столбца.
| ХАРАКТЕРИСТИКА | СРЕДА |
|
А) стабильный температурный режим
Б) ограниченность пространства
В) небольшие колебания температуры
Г) сложность широкого распространения большинства организма
Д) высокое содержание углекислого газа
Е) плотность высокая
|
1) почвенная
2) внутриорганизменная
|
Запишите в таблицу выбранные цифры под соответствующими буквами.
📜Теория для решения:
Среды обитания и экологические ниши
Введите ответ:
Посмотреть решение
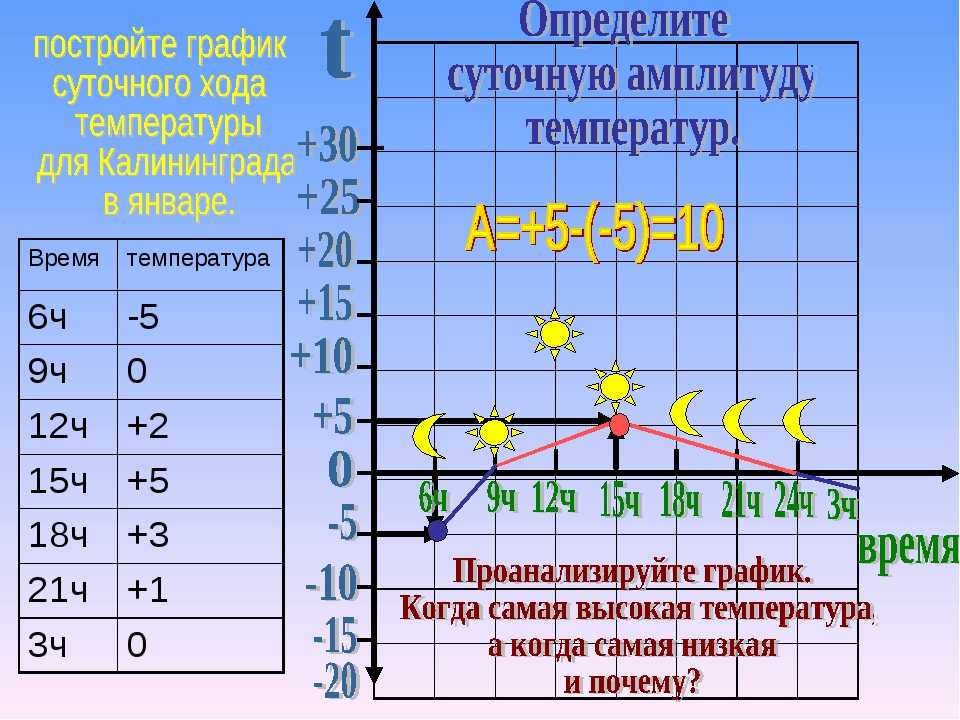
Итак, температурный режим. У взрослого человека в норме температура 36,6 во все сезоны и дни. У грунта же в этом плане жизнь более насыщенная: все меняется в зависимости от сезона и погодных условий. Колебания, конечно, могут быть большими, но по нашим вариантам, предположим, что сравниваем температуру утром и вечером.Сравнивать будем, приводя самим себе примеры: тело человека и грунт на улице.
У взрослого человека в норме температура 36,6 во все сезоны и дни. У грунта же в этом плане жизнь более насыщенная: все меняется в зависимости от сезона и погодных условий. Колебания, конечно, могут быть большими, но по нашим вариантам, предположим, что сравниваем температуру утром и вечером.Сравнивать будем, приводя самим себе примеры: тело человека и грунт на улице.
| А | Б | В | Г | Д | Е |
| 2 | 1 |
Сравним пространство. Грунт практически неограничен, в отличии от полости тела человека:
| А | Б | В | Г | Д | Е |
| 2 | 2 | 1 |
Из предыдущего пункта вытекает и «сложность широкого распространения большинства организма». Семенам проще попасть на другое поле, чем паразиту одного организма в организм другого.
| А | Б | В | Г | Д | Е |
| 2 | 2 | 1 | 2 |
В полости тела человека углекислого газа будет явно больше, чем в открытом поле.
| А | Б | В | Г | Д | Е |
| 2 | 2 | 1 | 2 | 2 |
Плотность почвы выше, чем плотность, например, плотность переваривающейся в тонком кишечнике пищи, если говорить об аскаридах.
| А | Б | В | Г | Д | Е |
| 2 | 2 | 1 | 2 | 2 | 1 |
Ответ: 221221
Ксения Алексеевна | Просмотров: 539
Тест «Экологические факторы. Среды жизни»
Тест по экологии «Экологические факторы. Среды жизни»
1. Задание
Установите соответствие между животным и средой, в которой оно обитает.
ЖИВОТНЫЕ |
| СРЕДА |
А) Печёночный сосальщик Б) Щука В) Дятел Г) Дождевой червь Д) Крот Е) Аскарида |
| 1) водная 2) наземно-воздушная 3) почвенная 4) организменная |
2. Задание
Задание
Установите соответствие между представителями ракообразных и средой их обитания.
ПРЕДСТАВИТЕЛИ |
| СРЕДА |
А) Речной рак Б) Камчатский краб В) Дафния Г) Мокрица Д) Циклоп Е) Креветки |
| 1) дно моря 2) придонная часть пресных водоемов 3) толща морской воды 4) влажная почва городов, лесная подстилка 5) толща воды пресных водоемов |
3. Задание
Установите соответствие между факторами среды и их характеристиками.
ХАРАКТЕРИСТИКА |
| ФАКТОР СРЕДЫ |
А) Постоянство газового состава атмосферы. Б) Изменение толщины озонового экрана. В) Изменение влажности воздуха. Г) Изменение численности консументов. Д) Изменение численности продуцентов. Е) Увеличение численности паразитов. |
| 1) биотические 2) абиотические |
4. Задание
Установите соответствие между фактором среды и группой, к которой он относится:
ГРУППА |
| ФАКТОР СРЕДЫ |
1) антропогенные 2) абиотические |
| А) искусственное орошение земель Б) падение метеорита В) распашка целины Г) весенний разлив вод Д) сооружение плотины Е) движение облаков |
5. Задание
Установите соответствие между экологическим фактором и его видом.
ФАКТОР |
| ВИД ФАКТОРА |
A) хищничество Б) отсутствие корма B) снежный покров Г) бобровая плотина Д) внесение удобрений в почву Е) смена времен года |
| 1) абиотический 2) биотический 3) антропогенный |
6. Задание
Установите соответствие между примером и группой экологических факторов, которые он иллюстрирует.
ПРИМЕР |
| ГРУППА ФАКТОРОВ |
А) зарастание пруда ряской Б) увеличение численности мальков рыб В) поедание мальков рыбы жуком-плавунцом Г) образование льда Д) смыв в реку минеральных удобрений |
| 1) биотические 2) абиотические |
7. Задание
Задание
Установите соответствие между характеристикой среды обитания и средой, соответствующей данной характеристике: к каждой позиции, данной в первом столбце, подберите соответствующую позицию из второго столбца.
ХАРАКТЕРИСТИКА |
| СРЕДА |
А) стабильный температурный режим Б) ограниченность пространства В) небольшие колебания температуры Г) сложность широкого распространения большинства организма Д) высокое содержание углекислого газа Е) плотность высокая |
| 1) почвенная 2) внутриорганизменная |
8. Задание
Приспособлением растений к жизни в засушливых условиях служит:
1) наличие воскового налёта на листьях
2) цветение до распускания листьев
3) образование многочисленных устьиц на листьях
4) способность накапливать воду в тканях
5) ярусное расположение организмов
6) глубоко уходящая в почву корневая система
9. Задание
Задание
Какие из перечисленных факторов окружающей среды относятся к антропогенным? Выберите три верных признака из шести и запишите цифры, под которыми они указаны.
1) температура воздуха
2) загрязнение парниковыми газами
3) наличие неперерабатываемого мусора
4) наличие дороги
5) освещённость
6) концентрация кислорода
10. Задание
Выберите три верных ответа из шести и запишите в таблицу цифры, под которыми они указаны. Какие биотические факторы могут привести к увеличению численности мышевидных грызунов в еловом лесу?
1) сокращение численности сов, ежей, лис
2) большой урожай семян ели
3) увеличение численности паразитов
4) рубка деревьев
5) глубокий снежный покров зимой
6) уменьшение численности паразитов
11. Задание
Задание
Выберите три верных ответа из шести и запишите в таблицу цифры, под которыми они указаны. Какие антропогенные факторы оказывают влияние на численность популяции ландыша майского в лесном сообществе?
1) вырубка деревьев
2) увеличение затененности
3) недостаток влаги в летний период
4) сбор дикорастущих растений
5) низкая температура воздуха зимой
6) вытаптывание почвы
12. Задание
Выберите три верных ответа из шести и запишите цифры, под которыми они указаны. Выберите характеристики наземно-воздушной среды обитания организмов.
1) давление в среде низкое
2) высокая плотность среды
3) содержание кислорода высокое
4) высокая теплопроводность
5) сезонные температурные перепады
6) ограниченная проницаемость для света
Прогноз максимальной температуры жизни на основе устойчивости метаболитов к разложению в воде
1. Кларк А. Термические пределы жизни на Земле. Междунар. Дж. Астробиол. 2014;13:141–154. [Google Scholar]
Кларк А. Термические пределы жизни на Земле. Междунар. Дж. Астробиол. 2014;13:141–154. [Google Scholar]
2. Бейнс В. Гипотезы, ограничения, модели и жизнь. Жизнь. 2015;5:1–3. [Бесплатная статья PMC] [PubMed] [Google Scholar]
3. Clarke A., Morris G.J., Fonseca F., Murray B.J., Acton E., Price H.C. Низкий температурный предел для жизни на Земле. ПЛОС Один. 2013;8:e66207. [Бесплатная статья PMC] [PubMed] [Google Scholar]
4. Такай К., Накамура К., Токи Т., Цуногай У., Миядзаки М., Миядзаки Дж., Хираяма Х., Накагава С., Нуноура Т., Хорикоши К. Пролиферация клеток при 122 °C и производство изотопно-тяжелого CH 4 гипертермофильным метаногеном при культивировании под высоким давлением. проц. Натл. акад. науч. США. 2008; 105:10949–10954. [Бесплатная статья PMC] [PubMed] [Google Scholar]
5. Кашефи К., Ловли Д.Р. Расширение верхнего температурного предела на всю жизнь. Наука. 2003;301:934. [PubMed] [Академия Google]
6. Деминг Дж.В., Баросс Дж. А. Глубоководные курильщики: окна в подповерхностную биосферу? Геохим. Космохим. Акта. 1993;57:3219–3230. [PubMed] [Google Scholar]
А. Глубоководные курильщики: окна в подповерхностную биосферу? Геохим. Космохим. Акта. 1993;57:3219–3230. [PubMed] [Google Scholar]
7. Коуэн Д.А. Верхняя температура для жизни — где мы проводим черту? Тенденции микробиол. 2004; 12:58–60. [PubMed] [Google Scholar]
8. Холден Дж. Некоторые любят погорячее: понимание границ жизни с помощью гипертермофильных микробов; Материалы 37-й научной ассамблеи КОСПАР; Монреаль, Канада. 13–20 июля 2008 г.; п. 1259. [Google Scholar]
9. Келли Д.С., Гиргуис П.Р., Уит Г., Кордес Э., Шренк М.О., Лин М., Баросс Дж.А., Делани Дж.Р. К определению верхнего температурного предела жизни. [(по состоянию на 6 марта 2015 г.)]. Доступно в Интернете: http://adsabs.harvard.edu/abs/2007AGUFM.V23D..02K
10. Danson M.J., Hough D.W. Энзимология архебактериальных путей центрального метаболизма. В: Дэнсон М.Дж., Хаф Д.В., Лант Г.Г., редакторы. Симпозиум биохимического общества: Архебактерии: биохимия и биотехнология. Портленд Пресс; Лондон, Великобритания: 1992. стр. 7–22. [Google Scholar]
стр. 7–22. [Google Scholar]
11. Катрицкий А.Р., Аллин С.М., Сискин М. Акватермолиз: Реакции органических соединений с перегретой водой. Акк. хим. Рез. 1996; 29: 399–406. [Google Scholar]
12. Крузе А., Диньюс Э. Горячая сжатая вода как реакционная среда и реагент 2. Реакции деградации. Дж. Суперкрит. Жидкости. 2007; 41: 361–379. [Google Scholar]
13. Вольфенден Р. Степени сложности водопотребляющих реакций в отсутствие ферментов. хим. Ред. 2006; 106:3379–3396. [PubMed] [Google Scholar]
14. Savage P.E. Органохимические реакции в сверхкритической воде. хим. Ред. 1999; 99: 603–621. [PubMed] [Google Scholar]
15. Нойхард Дж., Томассен Э. Обмен дезоксирибонуклеозидтрифосфатов в Escherichia coli 15 T во время тиминового голодания. Евро. Дж. Биохим. 1971; 20:36–43. [PubMed] [Google Scholar]
16. Ланг Э. В. Физико-химические пределы стабильности биомолекул. Доп. Космический Рез. 1986; 6: 251–255. [PubMed] [Академия Google]
17. Уайт Р.Х. Гидролитическая стабильность биомолекул при высоких температурах и ее значение для жизни при 250 °C. Природа. 1984; 310:430–432. [PubMed] [Google Scholar]
Уайт Р.Х. Гидролитическая стабильность биомолекул при высоких температурах и ее значение для жизни при 250 °C. Природа. 1984; 310:430–432. [PubMed] [Google Scholar]
18. Bernhardt G., Lüdemann H.D., Jaenicke R., König H., Stetter K.O. Биомолекулы нестабильны в условиях «черного курильщика». Натурвиссеншафтен. 1984; 71: 583–586. [Google Scholar]
19. Трент Дж.Д., Честейн Р.А., Яянос А.А. Возможная артефактная основа для очевидного роста бактерий при 250 ° C. Природа. 1984;307:737–740. [PubMed] [Google Scholar]
20. Янике Р. Стабильность белков и молекулярная адаптация к экстремальным условиям. Евро. Дж. Биохим. 1991; 202: 715–728. [PubMed] [Google Scholar]
21. Комитет по происхождению и эволюции жизни. Пределы органической жизни в планетных системах. Национальный исследовательский совет; Вашингтон, округ Колумбия, США: 2007. [Google Scholar]
22. Шофилд Л.Р., Пэтчетт М.Л., Паркер Э.Дж. Экспрессия, очистка и характеристика 3-дезокси-d-арабино-гептулозонат-7-фосфатсинтазы из Pyrococcus furiosus. Белок Экспр. Очист. 2004; 34:17–27. [PubMed] [Академия Google]
Белок Экспр. Очист. 2004; 34:17–27. [PubMed] [Академия Google]
23. Даниэль Р.М., Дэнсон М.Дж. Анализ активности и оценка термостабильности гипертермофильных ферментов. Методы Энзимол. 2001; 334: 283–293. [PubMed] [Google Scholar]
24. Daniel R.M., Cowan D.A. Биомолекулярная стабильность и жизнь при высоких температурах. Клетка. Мол. Жизнь наук. 2000; 57: 250–264. [PubMed] [Google Scholar]
25. Даниэль Р.М., ван Эккерт Р. Стабильность биомолекул и значение для жизни при высоких температурах. В: Wilcock WSD, Delong EF, Kelley DS, Baross JA, Cary SC, редакторы. Поддонная биосфера срединно-океанических хребтов: монография AGU 144. Американский геофизический союз; Вашингтон, округ Колумбия, США: 2004. [Google Scholar] 9.0003
26. Consalvi V., Chiaraluce R., Politi L., Vaccaro R., De Rosa M., Scandurra R. Чрезвычайно термостабильная глутаматдегидрогеназа из гипертермофильной архебактерии Pyrococcus furiosus. Евро. Дж. Биохим. 1991; 202: 1189–1196. [PubMed] [Google Scholar]
27. Маккомб Р.Б., Бонд Л.В., Бернетт Р.В., Кич Р.С., Бауэрс Г.Н., мл. Определение молярной абсорбционной способности НАДН. клин. хим. 1976; 22: 141–150. [PubMed] [Google Scholar]
Маккомб Р.Б., Бонд Л.В., Бернетт Р.В., Кич Р.С., Бауэрс Г.Н., мл. Определение молярной абсорбционной способности НАДН. клин. хим. 1976; 22: 141–150. [PubMed] [Google Scholar]
28. Ву Дж.Т., Ву Л.Х., Найт Дж.А. Стабильность НАДФН: влияние различных факторов на кинетику деградации. клин. хим. 1986;32:314–319. [PubMed] [Google Scholar]
29. Hudson R.C., Ruttersmith L.D., Daniel R.M. Глутаматдегидрогеназа из чрезвычайно термофильного архебактериального изолята AN1. Биохим. Биофиз. Акта. 1993; 1202: 244–250. [PubMed] [Google Scholar]
30. Robb F.T., Park J.-B., Adams M.W.W. Характеристика чрезвычайно термостабильной глутамдегидрогеназы: ключевого фермента в первичном метаболизме гипертермофильных архебактерий Pyrococcus furiosus. Биохим. Биофиз. Акта. 1992;1120:267–272. [PubMed] [Google Scholar]
31. Walsh K.A.J., Daniel R.M., Morgan H.W. Растворимая НАДН-дегидрогеназа (НАДН: феррицианидоксиредуктаза) из штамма Thermus aquaticus T351. Биохим. Дж. 1983; 209: 427–433. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
32. Никотри М.Е. Факторы, влияющие на предпочтения травоядных в еде. Дж. Эксп. Мар биол. Экол. 1980; 42:13–26. [Google Scholar]
33. Братбак Г., Дандас И. Содержание сухого вещества бактерий и оценка биомассы. заявл. Окружающая среда. микробиол. 1984;48:755–757. [Бесплатная статья PMC] [PubMed] [Google Scholar]
34. Ricketts T.R. О химическом составе некоторых одноклеточных водорослей. Фитохимия. 1966; 5: 67–76. [Google Scholar]
35. Баккен Л.Р., Олсен Р.А. Плавучая плотность и содержание сухого вещества в микроорганизмах: преобразование измеренного биообъема в биомассу. заявл. Окружающая среда. микробиол. 1983; 45: 1188–1195. [Бесплатная статья PMC] [PubMed] [Google Scholar]
36. Ланг Г., Райнерс В., Хейер Р. Потенциальное изменение химического состава осадков эпифитными лишайниками. Экология. 1976;25:229–241. [PubMed] [Google Scholar]
37. Чендлер С.Ф., Торп Т.А. Характеристика роста, водных отношений и накопления пролина в устойчивом к сульфату натрия каллюсе Brassica napus L. cv Westar (Canola) Plant Physiol. 1987; 84: 106–111. [Бесплатная статья PMC] [PubMed] [Google Scholar]
cv Westar (Canola) Plant Physiol. 1987; 84: 106–111. [Бесплатная статья PMC] [PubMed] [Google Scholar]
38. Блэк М., Корбино Ф., Джи Х., Ком Д. Содержание воды, раффиноза и дегидрины в индукции толерантности к высыханию в незрелых зародышах пшеницы. Завод Физиол. 1999; 120:463–472. [Бесплатная статья PMC] [PubMed] [Google Scholar]
39. Сяо Ю. Химико-кинетическая оценка максимальной температуры жизни. Департамент химической инженерии и биотехнологии, Кембриджский университет; Кембридж, Великобритания: 2014 г. [(по состоянию на 19 марта 2015 г.)]. Доступно на сайте: http://www.undergraduate.study.cam.ac.uk/courses/chemical-engineering [Google Scholar]
40. Yu C. Химико-кинетическая оценка максимальной температуры жизни. Департамент химической инженерии и биотехнологии, Кембриджский университет; Кембридж, Великобритания: 2014. [(по состоянию на 19март 2015 г.). Доступно на сайте: http://www.undergraduate.study.cam.ac.uk/courses/chemical-engineering [Google Scholar]
41. Antal M.J., Allen S.G., Schulman D., Xu X., Divilio R.J. Газификация биомассы в сверхкритической воде. Инд.Инж. хим. Рез. 2000;39:4040–4053. [Google Scholar]
Antal M.J., Allen S.G., Schulman D., Xu X., Divilio R.J. Газификация биомассы в сверхкритической воде. Инд.Инж. хим. Рез. 2000;39:4040–4053. [Google Scholar]
42. Чакинала А.Г., Брилман Д.В.Ф., ван Сваай В.П.М., Керстен С.Р.А. Каталитическая и некаталитическая сверхкритическая газификация воды микроводорослями и глицерином. Инд.Инж. хим. Рез. 2010;48:1113–1122. [Академия Google]
43. Лу Ю.Дж., Го Л.Дж., Цзи С.М., Чжан С.М., Хао С.Х., Ян К.Х. Производство водорода газификацией биомассы в сверхкритической воде: параметрическое исследование. Международный Дж. Гидрог. Энергия. 2006; 31: 822–831. [Google Scholar]
44. Мацумура Ю., Сасаки М., Окуда К., Таками С., Охара С., Уметсу М., Адшири Т. Сверхкритическая очистка биомассы для получения энергии и материалов. Сгорел. науч. Технол. 2006; 178: 509–536. [Google Scholar]
45. Петерсон А.А., Фогель Ф., Лашанс Р.П., Фролинг М., Антал Дж.М.Дж., Тестер Дж.В. Производство термохимического биотоплива в гидротермальных средах: обзор технологий суб- и сверхкритической воды. Энергетическая среда. науч. 2008; 1:32–65. [Академия Google]
Энергетическая среда. науч. 2008; 1:32–65. [Академия Google]
46. Кабьемела Б.М., Адшири Т., Малалуан Р.М., Араи К. Разложение глюкозы и фруктозы в субкритической и сверхкритической воде: подробный путь реакции, механизмы и кинетика. Инд.Инж. хим. Рез. 1999; 38: 2888–2895. [Google Scholar]
47. Хаджави С.Х., Кимура Ю., Оомори Т., Мацуно Р., Адачи С. Кинетика деградации моносахаридов в субкритической воде. Дж. Фуд Инж. 2005; 68: 309–313. [Google Scholar]
48. Оефнер П.Дж., Ланцинер А.Х., Бонн Г., Боблетер О. Количественные исследования образования фурфурола и органических кислот при гидротермальном, кислотном и щелочном разложении D-ксилозы. Monatshefte für Chemie. 1992;123:547–556. [Google Scholar]
49. Усуки С., Кимура Ю., Адачи С. Деградация пентоз и гексауроновых кислот в субкритической воде. хим. англ. Технол. 2008; 31: 133–137. [Google Scholar]
50. Qi J., Xiuyang L. Кинетика некаталитического разложения D-ксилозы в высокотемпературной жидкой воде.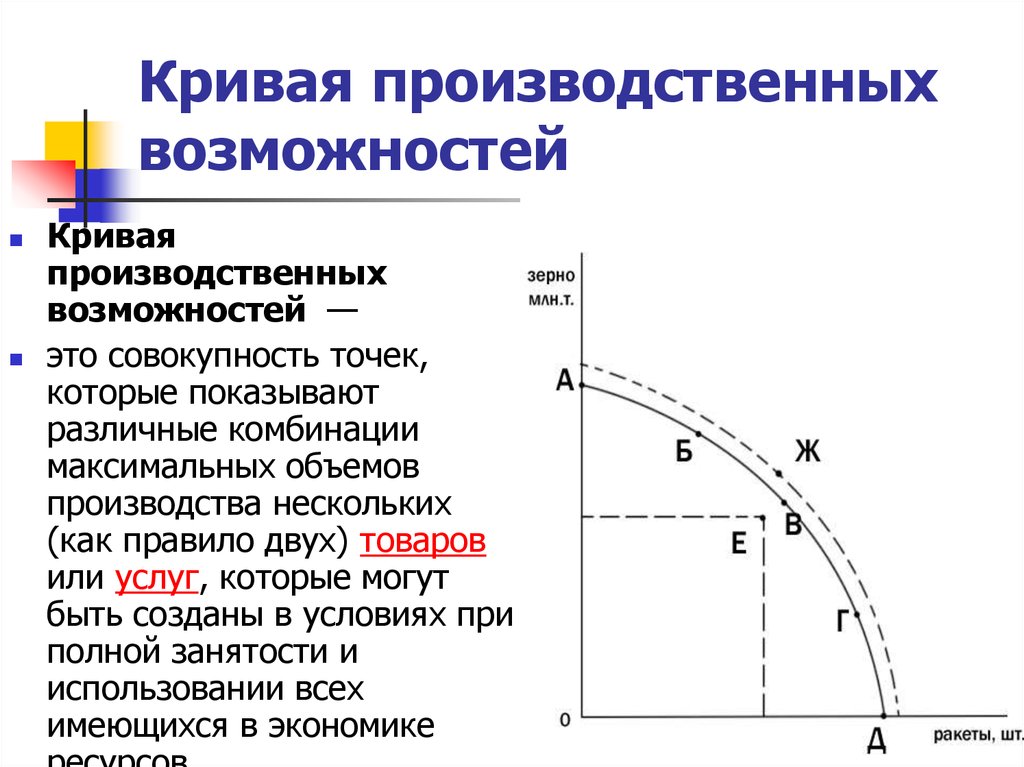 Подбородок. Дж. Хим. англ. 2007; 15: 666–669. [Google Scholar]
Подбородок. Дж. Хим. англ. 2007; 15: 666–669. [Google Scholar]
51. Jing Q., LÜ X. Кинетика некаталитического разложения D-ксилозы в высокотемпературной жидкой воде. Подбородок. Дж. Хим. англ. 2007; 15: 666–669.. [Google Scholar]
52. Банди Ф.П., Бассет В.А., Уэзерс М.С., Хемли Р.Дж., Мао Х.У., Гончаров А.Ф. Диаграмма фазового и температурного превращения углерода, обновленная до 1994 г. Углерод. 1996; 34: 141–153. [Google Scholar]
53. Татеяма Ю., Огицу Т., Кусакабэ К., Цунеюки С. Исследование первых принципов при постоянном давлении переходных состояний графит-алмазного превращения. физ. Ред. Б. 1996; 54:14954–15001. [PubMed] [Google Scholar]
54. Массант Дж. Как термофилы справляются с термолабильными метаболитами. В: Gerday G., Glansdorff N., редакторы. Физиология и биохимия экстремофилов. АСМ Пресс; Вашингтон, округ Колумбия, США: 2007. стр. 57–74. [Академия Google]
55. Марбе А.Ю., Ноэль Г., Детру А.М., Вертоммен Д., Ван Шафтинген Э., Линстер К. Л. Чрезвычайно консервативная АТФ- или АДФ-зависимая ферментная система для репарации никотинамидных нуклеотидов. Дж. Биол. хим. 2011; 286:41246–41252. [PMC free article] [PubMed] [Google Scholar]
Л. Чрезвычайно консервативная АТФ- или АДФ-зависимая ферментная система для репарации никотинамидных нуклеотидов. Дж. Биол. хим. 2011; 286:41246–41252. [PMC free article] [PubMed] [Google Scholar]
56. Yuan J., Doucette C.D., Fowler W.U., Feng X.J., Piazza M., Rabitz H.A., Wingreen N.S., Rabinowitz J.D. Метаболомический количественный анализ ассимиляции аммиака в Кишечная палочка . Мол. Сист. биол. 2009 г.;5 doi: 10.1038/msb.2009.60. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
57. Пайн М. Дж. Стационарное измерение оборота аминокислот в клеточных белках растущей Escherichia coli : существование двух кинетически различных реакций. Дж. Бактериол. 1970; 103: 207–215. [Бесплатная статья PMC] [PubMed] [Google Scholar]
58. Пайн М. Дж. Оборот внутриклеточных белков. Энн. Преподобный Микробиолог. 1972; 26: 103–126. [PubMed] [Академия Google]
59. Браун К.Д. Поддержание и обмен пула ароматических аминокислот в Escherichia coli . Дж. Бактериол. 1971; 106: 70–81. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Дж. Бактериол. 1971; 106: 70–81. [Бесплатная статья PMC] [PubMed] [Google Scholar]
60. Enjalbert B., Letisse F., Portais J.-C. Физиологическое и молекулярное время перехода глюкозы в ацетат в Escherichia coli . Метаболиты. 2013;3:820–837. [Бесплатная статья PMC] [PubMed] [Google Scholar]
61. Kanfer J., Kennedy E.P. Метаболизм и функция бактериальных липидов: I. МЕТАБОЛИЗМ ФОСФОЛИПИДОВ В ESCHERICHIA COLI B. J. Biol. хим. 1963;238:2919–2922. [PubMed] [Google Scholar]
62. Голден Н.Г., Пауэлл Г.Л. Строгий и ослабленный контроль метаболизма фосфолипидов в Escherichia coli . Дж. Биол. хим. 1972; 247:6651–6658. [PubMed] [Google Scholar]
63. Шауб Дж., Ройсс М. Динамика гликолиза in vivo в Escherichia coli показывает необходимость анализа метаболома, зависящего от скорости роста. Биотехнолог. Прогресс. 2008; 24:1402–1407. [PubMed] [Google Scholar]
64. Таймаз-Никерел Х., де Мей М., Рас С., тен Пьерик А., Сейфар Р.М., ван Дам Дж. К., Хейнен Дж.Дж., ван Гулик В.М. Разработка и применение дифференциального метода надежного анализа метаболома в Кишечная палочка . Анальный. Биохим. 2009; 386:9–19. [PubMed] [Google Scholar]
К., Хейнен Дж.Дж., ван Гулик В.М. Разработка и применение дифференциального метода надежного анализа метаболома в Кишечная палочка . Анальный. Биохим. 2009; 386:9–19. [PubMed] [Google Scholar]
65. Millard P., Massou S., Wittmann C., Portais J.C., Letisse F. Отбор проб внутриклеточных метаболитов для стационарного и нестационарного анализа метаболического потока 13C в Escherichia coli . Анальный. Биохим. 2014; 465:38–49. [PubMed] [Google Scholar]
66. Чепмен А.Г., Аткинсон Д.Е. Концентрации адениновых нуклеотидов и скорости оборота. Их корреляция с биологической активностью бактерий и дрожжей. В: Уилкинсон Дж. Ф., редактор. Достижения микробной физиологии. Эльзевир; Амстердам, Нидерланды: 1977. стр. 253–306. [PubMed] [Google Scholar]
67. Валлари Д.С., Яковски С. Биосинтез и деградация способствуют регуляции содержания кофермента А в Escherichia coli . Дж. Бактериол. 1988; 170:3961–3966. [Бесплатная статья PMC] [PubMed] [Google Scholar]
68. Легрен С., Демарез М., Глансдорф Н., Пьерар А. Аммиакозависимый синтез и метаболическое направление карбамоилфосфата у гипертермофильных архей Pyrococcus furiosus. Микробиология. 1995;141:1093–1099. [Google Scholar]
Легрен С., Демарез М., Глансдорф Н., Пьерар А. Аммиакозависимый синтез и метаболическое направление карбамоилфосфата у гипертермофильных архей Pyrococcus furiosus. Микробиология. 1995;141:1093–1099. [Google Scholar]
69. Sterner R., Kleemann G.R., Szadkowski H., Lustig A., Kirschner K., Hennig M. Фосфорибозилантранилатизомераза из Thermutuga maritima — чрезвычайно стабильный и активный гомодим. Белковая наука. 1996; 5:2000–2008. [Бесплатная статья PMC] [PubMed] [Google Scholar]
70. Sanchez R., Baetens M., van De Casteele M., Roovers M., Legrain C., Glansdorff N. Орнитинкарбамоилтрансфераза из анализа Extreme Thermophile Thermus Thermophilus Гена и характеристика белка. Евро. Дж. Биохим. 1997;248:466–474. [PubMed] [Google Scholar]
71. Дэниел Р. М., Дэнсон М. Дж. Использовали ли примитивные микроорганизмы белки негемового железа вместо НАД/Ф? Дж. Мол. Эвол. 1995; 40: 559–563. [Google Scholar]
72. Kengen S.W.M., Tuininga J.E., de Bok F.A.M., Stams AJM., de Vos W. M. Очистка и характеристика новой АДФ-зависимой глюкокиназы из гипертермофильного архея Pyrococcus furiosus. Дж. Биол. хим. 1995; 270:30453–30457. [PubMed] [Google Scholar]
M. Очистка и характеристика новой АДФ-зависимой глюкокиназы из гипертермофильного архея Pyrococcus furiosus. Дж. Биол. хим. 1995; 270:30453–30457. [PubMed] [Google Scholar]
73. Dörr C., Zaparty M., Tjaden B., Brinkmann H., Siebers B. Гексокиназа Hyperthermophile Thermoproteus tenax: АТФ-зависимые гексокиназы и АДФ-зависимые глюкокиназы, две альтернативы для фосфорилирования глюкозы у архей. Дж. Биол. хим. 2003; 278:18744–18753. [PubMed] [Академия Google]
74. Schönheit P., Brandis A., Thauer R. Деградация ферредоксина в растущей Clostridium pasteurianum в периоды дефицита железа. Арка микробиол. 1979; 120:73–76. [PubMed] [Google Scholar]
75. Кейтс М. Биология галофильных бактерий, часть II. Опыт. 1993; 49: 1027–1036. [PubMed] [Google Scholar]
76. Вильянуэва Л., Дамсте Дж. С. С., Схоутен С. Переоценка пути биосинтеза липидов мембран архей. Нац. Преподобный Микро. 2014;12:438–448. [PubMed] [Академия Google]
77. Le Noble W.J., Daka M.R. Кинетика реакций в растворах под давлением. 52. Влияние давления на согласованные и ступенчатые сигматропные сдвиги. Варенье. хим. соц. 1978; 100: 5961–5962. [Google Scholar]
52. Влияние давления на согласованные и ступенчатые сигматропные сдвиги. Варенье. хим. соц. 1978; 100: 5961–5962. [Google Scholar]
78. Гоникберг М.Г. Химические равновесия и скорости реакций при высоких давлениях (Перевод Дж. Шморака) Национальный научный фонд; Вашингтон, округ Колумбия, США: 1960. [Google Scholar]
79. Eckert C.A. Кинетика высокого давления в растворе. Энн. Преподобный физ. хим. 1972; 23: 239–264. [Академия Google]
80. Айер С.Д., Клейн М.Т. Влияние давления на скорость гидролиза бутиронитрила в высокотемпературной воде. Дж. Суперкрит. Жидкости. 1997; 10: 191–200. [Google Scholar]
81. Лейдлер К.Дж., Чен Д. Влияние давления на кинетику щелочного гидролиза сложных эфиров и амидов. Транс. Фарадей Сок. 1958; 54: 1026–1033. [Google Scholar]
82. Балига Б.Т., Уолли Э. Эффект давления и механизм катализируемой кислотой гидратации пропилена и изобутилена. Может. Дж. Хим. 1964;42:1019–1026. [Google Scholar]
83. Гей Д.Л., Уолли Э. Влияние давления на сольволиз бензилхлорида в смесях глицерин-вода. Может. Дж. Хим. 1970;48:2021–2024. [Google Scholar]
Влияние давления на сольволиз бензилхлорида в смесях глицерин-вода. Может. Дж. Хим. 1970;48:2021–2024. [Google Scholar]
84. Маккиннон М., Латиф А.Б., Хайн Дж.Б. Объемы переходных состояний и механизмы сольволиза. Может. Дж. Хим. 1970;48:2025–2030. [Google Scholar]
85. Le Noble W.J., Srivastava S., Breslow R., Trainor G. Влияние давления на гидролиз двух сложных эфиров, стимулируемых циклодекстрином. Варенье. хим. соц. 1983;105:2745–2748. [Google Scholar]
86. Танигучи Ю., Макимото С., Судзуки К.З. Влияние давления на гидролиз п-нитрофенил- и 2-нафтилацетатов, катализируемый циклодекстринами. Дж. Физ. хим. 1981; 85: 3469–3472. [Google Scholar]
87. Коскикаллио Дж., Поули Д., Уолли Э. Эффект давления и механизм в кислотном катализе. V. Гидролиз уксусного ангидрида. Может. Дж. Хим. 1959; 37: 1360–1366. [Google Scholar]
88. Ле Нобль В. Дж. Кинетика реакций в растворах под давлением. В: Streitwieser AJ, Taft RW, редакторы. Progress in Physical Organic Chemistry v 5. Interscience Publishers; Нью-Йорк, штат Нью-Йорк, США: 1967. стр. 207–330. [Google Scholar]
Interscience Publishers; Нью-Йорк, штат Нью-Йорк, США: 1967. стр. 207–330. [Google Scholar]
89. Коскикаллио Дж., Уолли Э. Влияние давления на спонтанный и катализируемый основаниями гидролиз эпоксидов. Транс. Фарадей Сок. 1959; 37: 783–787. [Google Scholar]
90. Осборн А.Р., Уолли Э. Эффект давления и механизм в кислотном катализе. VII. Гидролиз метил-, этил- и трет-бутилацетатов. Может. Дж. Хим. 1961; 39: 1101–1108. [Google Scholar]
91. Фарр Д. Технология высокого давления в пищевой промышленности. Тенденции Food Sci. Технол. 1990;1:14–16. [Google Scholar]
92. Гросс М., Янике Р. Белки под давлением. Влияние высокого гидростатического давления на структуру, функцию и сборку белков и белковых комплексов. Евро. Дж. Биохим. 1994; 221:617–630. [PubMed] [Google Scholar]
93. Schmid G., Ludemann H.-D., Jaenicke R. Окисление сульфгидрильных групп в лактатдегидрогеназе при высоком гидростатическом давлении. Евро. Дж. Биохим. 1978; 86: 219–224. [PubMed] [Google Scholar]
94. Аоки К., Хирамацу К., Танака М., Канешина С. Альбумин бычьей сыворотки под воздействием высокого давления. Биохим. Биофиз. Акта. 1968;160:368–377. [PubMed] [Google Scholar]
Аоки К., Хирамацу К., Танака М., Канешина С. Альбумин бычьей сыворотки под воздействием высокого давления. Биохим. Биофиз. Акта. 1968;160:368–377. [PubMed] [Google Scholar]
95. Демазо Г., Ривален Н. Высокое гидростатическое давление и биология: Краткий обзор. заявл. микробиол. Биотехнолог. 2011;89:1305–1314. [PubMed] [Google Scholar]
96. Шок Э.Л. Уравновешиваются ли аминокислоты в гидротермальных флюидах? Геохим. Космохим. Акта. 1990; 54: 1185–1189. [Google Scholar]
97. Шок Е.Л. Стабильность пептидов в высокотемпературных водных растворах. Геохим. Космохим. Акта. 1992;56:3481–3491. [Академия Google]
98. Швергольд Б.С. Реакции Майяра у гипертермофильных архей: значение для лучшего понимания неферментативного гликирования в биологии. Омоложение Рез. 2013; 16: 259–272. [PubMed] [Google Scholar]
99. Хуссейн А., Шурман П. Тиоловые эфиры 11: кинетическое исследование гидролиза и аминолиза пропионилтиохолина йодида и 2-диметиламиноэтантиолпропионата. Дж. Фарм. науч. 1969; 58: 687–693. [PubMed] [Google Scholar]
Дж. Фарм. науч. 1969; 58: 687–693. [PubMed] [Google Scholar]
100. Леви М., Миллер С.Л. Стабильность оснований РНК: значение для происхождения жизни. проц. Натл. акад. науч. США. 1998;95:7933–7938. [Бесплатная статья PMC] [PubMed] [Google Scholar]
101. Кавамура К. Мониторинг гидротермальных реакций в миллисекундном масштабе с использованием проточного реактора с микротрубками и кинетика гидролиза АТФ для гипотезы мира РНК. Бык. хим. соц. Япония. 2000; 73: 1805–1811. [Google Scholar]
102. Стокбридж Р.Б., Шредер Г.К., Вольфенден Р. Скорость спонтанного расщепления гликозидной связи аденозина. Биоорганическая хим. 2010; 38: 224–228. [Бесплатная статья PMC] [PubMed] [Google Scholar]
103. Абдельмоез В., Йошида Х., Накахаси Т. Пути трансформации и разложения аминокислот в условиях насыщенной докритической воды. Междунар. Дж. Хим. Реактор инж. 2010; 8 doi: 10.2202/1542-6580.1903. [CrossRef] [Google Scholar]
104. Cox J.S., Seward T.M. Кинетика реакции аланина и глицина в гидротермальных условиях. Геохим. Космохим. Акта. 2007; 71: 2264–2284. [Google Scholar]
Геохим. Космохим. Акта. 2007; 71: 2264–2284. [Google Scholar]
105. Li J., Brill T.B. Спектроскопия гидротермических реакций 25: Кинетика декарбоксилирования белковых аминокислот и влияние боковых цепей на гидротермическую стабильность. Дж. Физ. хим. А. 2003; 107:5987–5992. [Google Scholar]
106. Сато Н., Квитейн А.Т., Канг К., Даймон Х., Фуджи К. Кинетика реакции разложения аминокислот в воде при высокой температуре и высоком давлении. Инд.Инж. хим. Рез. 2004;43:3217–3222. [Google Scholar]
107. Гейгер Т., Стивен С. Деамидирование, изомеризация и рацемизация аспарагиниловых и аспартильных остатков в пептидах. Дж. Биол. хим. 1987; 262: 785–794. [PubMed] [Google Scholar]
108. Cox J.S., Seward T.M. Кинетика гидротермальной реакции аспарагиновой кислоты. Геохим. Космохим. Акта. 2007;71:797–820. [Google Scholar]
109. Faisal M., Sato N., Quitain A.T., Daimon H., Fujie K. Кинетика реакции и путь гидротермального разложения аспарагиновой кислоты. Междунар. Дж. Хим. Кинет. 2007; 39: 175–180. [Google Scholar]
Дж. Хим. Кинет. 2007; 39: 175–180. [Google Scholar]
110. Холмс У.Х., Гамильтон И.Д., Робертсон А.Г. Скорость оборота пула аденозинтрифосфата Escherichia coli , растущего в аэробных условиях в среде простого состава. Архив микробиологии. 1972; 83: 95–109. [PubMed] [Google Scholar]
111. Оомори Т., Хаджави С.Х., Кимура Ю., Адачи С., Мацуно Р. Гидролиз дисахаридов, содержащих остаток глюкозы, в субкритической воде. Биохим. англ. Дж. 2004; 18:143–147. [Академия Google]
112. Буйске Д.А., Хандшумахер Р.Е., Шиллинг Э.Д., Стронг Ф.М. Стабильность кофермента А1. Варенье. хим. соц. 1954; 76: 3575–3577. [Google Scholar]
113. Снайдер М.Дж., Гауниц С., Риджуэй С., Шорт С.А., Вольфенден Р. Влияние температуры на каталитическую эффективность, повышение скорости и сродство переходного состояния цитидиндезаминазы и термодинамические последствия для катализа Снятие субстратного «якоря» Биохимия. 2000; 39: 9746–9753. [PubMed] [Академия Google]
114. Garrett E. R., Tsau J. Сольволиз цитозина и цитидина. Дж. Фарм. науч. 1972; 61: 1052–1061. [PubMed] [Google Scholar]
R., Tsau J. Сольволиз цитозина и цитидина. Дж. Фарм. науч. 1972; 61: 1052–1061. [PubMed] [Google Scholar]
115. Линдал Т., Найберг Б. Дезаминирование остатков цитозина в дезоксирибонуклеиновой кислоте, индуцированное нагреванием. Биохимия. 1974; 13:3405–3410. [PubMed] [Google Scholar]
116. Фредерико Л.А., Кункель Т.А., Шоу Б.Р. Дезаминирование цитозина в несовпадающей паре оснований. Биохимия. 1993; 32: 6523–6530. [PubMed] [Google Scholar]
117. Shen J.-C., Rideout W.M.I., Jones P.A. Скорость гидролитического дезаминирования 5-метилцитозина в двухцепочечной ДНК. Нукл. Кислоты рез. 1994;22:972–976. [Бесплатная статья PMC] [PubMed] [Google Scholar]
118. Гаррет Э. Р., Мехта П. Дж. Сольволиз адениновых нуклеозидов. II. Влияние сахаров и адеминовых заместителей на щелочной сольволиз. Варенье. хим. соц. 1972; 94: 8542–8547. [PubMed] [Google Scholar]
119. Кабиемела Б.М., Адшири Т., Малалуан Р., Араи К. Кинетика разложения дигидроксиацетона и глицеральдегида в субкритической и сверхкритической воде. Инд.Инж. хим. Рез. 1997;36:2025–2030. [Академия Google]
Инд.Инж. хим. Рез. 1997;36:2025–2030. [Академия Google]
120. Ю. Дж., Сэвидж П.Е. Разложение муравьиной кислоты в гидротермальных условиях. Инд.Инж. хим. Рез. 1998; 37: 2–10. [Google Scholar]
121. Maiella P.G., Brill T.B. Спектроскопия гидротермальных реакций. 10. Доказательства пристеночных эффектов в кинетике декарбоксилирования 1,00 м HCO 2 X (X = H, Na) при 280–330 °C и 275 бар. Дж. Физ. хим. А. 1998; 102: 5886–5891. [Google Scholar]
122. Myung S., Wang Y., Zhang Y.H.P. Фруктозо-1,6-бисфосфатаза гипертермофильной бактерии Thermotoga maritima: характеристика, стабильность метаболитов и ее последствия. Процесс биохим. 2010; 45:1882–1887. [Академия Google]
123. Bearne S.L., Wolfenden R. Ферментативная гидратация олефина: нагрузка, которую несет фумараза. Варенье. хим. соц. 1995; 117:9588–9589. [Google Scholar]
124. De Mey M., Taymaz-Nikerel H., Baart G., Waegeman H., Maertens J., Heijnen J.J., van Gulik W.M. Улавливание быстрой динамики метаболитов в Escherichia coli с помощью BioScope в условиях обогащения кислородом.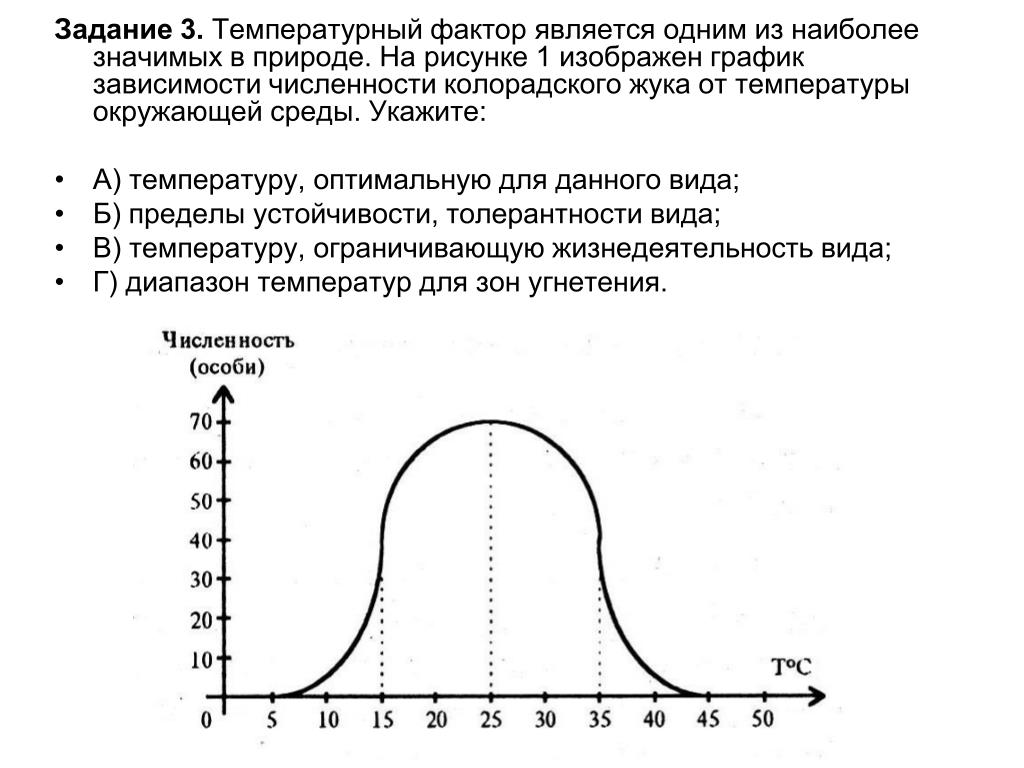 Метаб. англ. 2010;12:477–487. [PubMed] [Google Scholar]
Метаб. англ. 2010;12:477–487. [PubMed] [Google Scholar]
125. Ван Р., Кобаяши Т., Адачи С. Разложение N-ацетил-D-глюкозамина и D-глюкозамина в субкритической воде и свойства продуктов разложения. Пищевая наука. Технол. Рез. 2011; 17: 273–278. [Академия Google]
126. Qian Y., Engel M.H., Macko S.A., Carpenter S., Deming J.W. Кинетика гидролиза пептидов и распада аминокислот при высокой температуре. Геохим. Космохим. Акта. 1993;57:3281–3293. [PubMed] [Google Scholar]
127. Снайдер М.Дж., Вольфенден Р. Скорость спонтанного декарбоксилирования аминокислот. Варенье. хим. соц. 2000; 122:11507–11508. [Google Scholar]
128. Abdelmoez W., Nakahasi T., Yoshida H. Трансформация и разложение аминокислот в насыщенной докритической воде. Инд.Инж. хим. Рез. 2007; 46: 5286–529.4. [Google Scholar]
129. Кавамура К., Юкиока М. Кинетика рацемизации аминокислот при 225–275 °С с использованием метода мониторинга гидротермальных реакций в реальном времени. Термохим. Акта.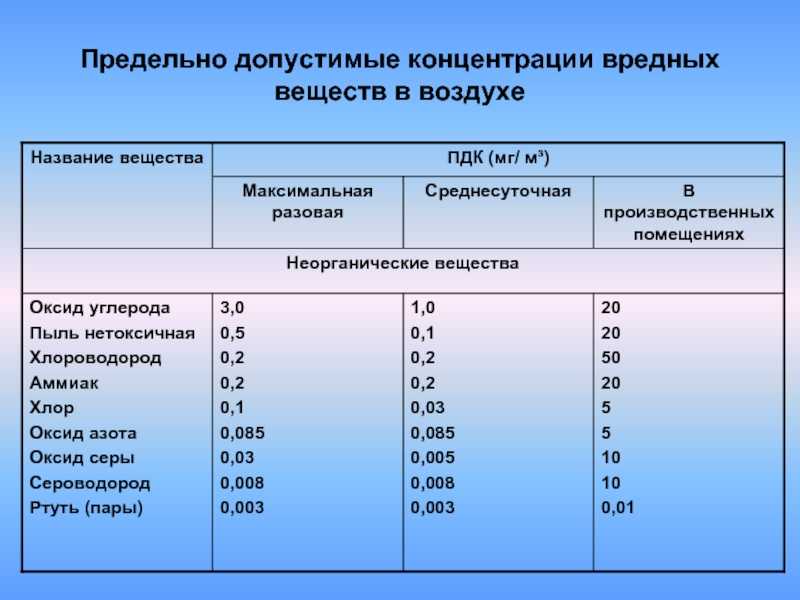 2001; 375:9–16. [Google Scholar]
2001; 375:9–16. [Google Scholar]
130. Кобаяши Т., Такасе К., Адачи С. Кинетика деградации аминокислот с разветвленной цепью в субкритической воде. Бионауч. Биотехнолог. Биохим. 2010; 74: 649–651. [PubMed] [Google Scholar]
131. Kocsisova T., Juhasz J., Cvengros J. Гидролиз эфиров жирных кислот в субкритической воде. Евро. J. Науки о липидах. Технол. 2006; 108: 652–658. [Академия Google]
132. Майэлла П.Г., Брилл Т.Б. Спектроскопия гидротермальных реакций. 5. Кинетика декарбоксилирования малоновой кислоты и малоната натрия. Дж. Физ. хим. 1996; 100:14352–14355. [Google Scholar]
133. Холл Г.А. Кинетика разложения малоновой кислоты в водном растворе. Варенье. хим. соц. 1949; 71: 2691–2693. [Google Scholar]
134. Радзицкая А., Вольфенден Р. Опытный фермент. Наука. 1995; 267: 90–93. [PubMed] [Google Scholar]
135. Геллес Э. Кинетика декарбоксилирования щавелевоуксусной кислоты. Дж. Хим. соц. (возобновлено) 1956:4736–4739. [Google Scholar]
136. Грит М., Ундерберг В.Дж.М., Кроммелин Д.Дж.А. Гидролиз насыщенного соевого фосфатидилхолина в водных дисперсиях липосом. Дж. Фарм. науч. 1993; 82: 362–366. [PubMed] [Google Scholar]
Грит М., Ундерберг В.Дж.М., Кроммелин Д.Дж.А. Гидролиз насыщенного соевого фосфатидилхолина в водных дисперсиях липосом. Дж. Фарм. науч. 1993; 82: 362–366. [PubMed] [Google Scholar]
137. Бельский А.Дж., Майэлла П.Г., Брилл Т.Б. Спектроскопия гидротермических реакций 13. Кинетика и механизмы декарбоксилирования производных уксусной кислоты при 100-260 °С при 275 бар. Дж. Физ. хим. А. 1999; 103:4253–4260. [Google Scholar]
138. Larralde R., Robertson M.P., Miller S.L. Скорость разложения рибозы и других сахаров: значение для химической эволюции. проц. Натл. акад. науч. США. 1995;92:8158–8160. [Бесплатная статья PMC] [PubMed] [Google Scholar]
139. Haghighat Khajavi S., Kimura Y., Oomori T., Matsuno R., Adachi S. Кинетика разложения сахарозы в субкритической воде. LWT – пищевая наука. Технол. 2005; 38: 297–302. [Google Scholar]
140. Shaw W.H.R., Bordeux J.J. Разложение мочевины в водных средах. Варенье. хим. соц. 1955; 77: 4729–4733. [Google Scholar]
Стабильность образцов электролитов цельной крови при комнатной температуре по сравнению с условиями ледяной каши
Сохранить цитату в файл
Формат:
Резюме (текст) PubMedPMIDAbstract (текст) CSV
Добавить в коллекции
- Создать новую коллекцию
- Добавить в существующую коллекцию
Назовите свою коллекцию:
Имя должно содержать менее 100 символов
Выберите коллекцию:
Невозможно загрузить вашу коллекцию из-за ошибки
Повторите попытку
Добавить в мою библиографию
- Моя библиография
Не удалось загрузить делегатов из-за ошибки
Повторите попытку
Ваш сохраненный поиск
Название сохраненного поиска:
Условия поиска:
Тестовые условия поиска
Электронное письмо:
(изменить)
Который день?
Первое воскресеньеПервый понедельникПервый вторникПервая средаПервый четвергПервая пятницаПервая субботаПервый деньПервый рабочий день
Который день?
воскресеньепонедельниквторниксредачетвергпятницасуббота
Формат отчета:
РезюмеРезюме (текст)АбстрактАбстракт (текст)PubMed
Отправить максимум:
1 шт. 5 шт. 10 шт. 20 шт. 50 шт. 100 шт. 200 шт.
5 шт. 10 шт. 20 шт. 50 шт. 100 шт. 200 шт.
Отправить, даже если нет новых результатов
Необязательный текст в электронном письме:
Создайте файл для внешнего программного обеспечения для управления цитированием
. 2022 2 марта; 7 (2): 541-554.
дои: 10.1093/jalm/jfab089.
Джеральд С Заворски
1
, Ксандер М. Р. ван Вейк
2
, Самуэль Гаспарян
3
, Николай С. Столленверк
4
, Ребекка А. Брукс
5
Принадлежности
- 1 Пульмонологические службы и лаборатории газов крови, Калифорнийский университет, Дэвис, Медицинский центр, Сакраменто, Калифорния, США.

- 2 Кафедра патологии Чикагского университета, Чикаго, Иллинойс, США.
- 3 Респираторные службы, Stanford Healthcare, Пало-Альто, Калифорния, США.
- 4 Отделение внутренней медицины, Отделение пульмонологии, интенсивной терапии и медицины сна, Калифорнийский университет, Дэвис, Медицинский центр, Сакраменто, Калифорния, США.
- 5 Отделение акушерства и гинекологии, Отделение гинекологической онкологии, Калифорнийский университет, Дэвис, Медицинский центр, Сакраменто, Калифорния, США.
PMID:
34448844
DOI:
10.
 1093/jalm/jfab089
1093/jalm/jfab089
Джеральд С. Заворски и соавт.
J Appl Lab Med.
.
. 2022 2 марта; 7 (2): 541-554.
дои: 10.1093/jalm/jfab089.
Авторы
Джеральд С Заворски
1
, Ксандер М. Р. ван Вейк
2
, Самуэль Гаспарян
3
, Николай С. Столленверк
4
, Ребекка А. Брукс
5
Принадлежности
- 1 Пульмонологические службы и лаборатории газов крови, Калифорнийский университет, Дэвис, Медицинский центр, Сакраменто, Калифорния, США.

- 2 Кафедра патологии Чикагского университета, Чикаго, Иллинойс, США.
- 3 Респираторные службы, Stanford Healthcare, Пало-Альто, Калифорния, США.
- 4 Отделение внутренней медицины, Отделение пульмонологии, интенсивной терапии и медицины сна, Калифорнийский университет, Дэвис, Медицинский центр, Сакраменто, Калифорния, США.
- 5 Отделение акушерства и гинекологии, Отделение гинекологической онкологии, Калифорнийский университет, Дэвис, Медицинский центр, Сакраменто, Калифорния, США.
PMID:
34448844
DOI:
10.
 1093/jalm/jfab089
1093/jalm/jfab089
Абстрактный
Задний план:
Данные о стабильности электролитов цельной крови ограничены небольшими размерами образцов. Мы стремились определить стабильность электролитов цельной крови при комнатной температуре и в условиях ледяной слякоти у пациентов-людей в крупном больничном центре.
Методы:
Образцы цельной крови были получены от 203 пациентов, госпитализированных по поводу различных патофизиологических состояний. Концентрации натрия, калия [K+], ионизированного кальция и хлорида в электролитах измеряли в 5 различных временных точках, охватывающих 3 часа. Образцы перед анализом хранили при комнатной температуре (22–24 °C) или в условиях ледяной шуги (0,1–0,2 °C).
Результаты:
В обоих условиях натрий, ионизированный кальций и хлорид не показали заметного изменения до 109 минут по сравнению с исходным уровнем; однако среднее увеличение [K+] за 138 минут хранения в ледяной жиже составило от 0,0032 (от 0,0021 [5-й процентиль] до 0,0047 [95-й процентиль]) ммоль/л/мин (скорректированный R2 = 0,62, P <0,001). Пять процентов образцов продемонстрировали изменение [K+] на ≥0,3 ммоль/л по сравнению с исходным уровнем после 67 минут хранения во льду. Напротив, 1% образцов, хранившихся при комнатной температуре, показали такое же изменение в тот же момент времени.
Пять процентов образцов продемонстрировали изменение [K+] на ≥0,3 ммоль/л по сравнению с исходным уровнем после 67 минут хранения во льду. Напротив, 1% образцов, хранившихся при комнатной температуре, показали такое же изменение в тот же момент времени.
Выводы:
Концентрации натрия, [K+], ионизированного кальция и хлоридов в цельной крови остаются стабильными в течение не менее 109 мин при комнатной температуре. Тем не менее, образцы цельной крови, хранящиеся в ледяной жиже не более 67 минут, демонстрируют 5% вероятность того, что концентрация [K+] увеличится как минимум на 0,3 ммоль/л по сравнению с исходным уровнем. Другие аналиты не дестабилизируются до 178 мин хранения ледяной шуги.
Ключевые слова:
артериальный; критически болен; кинетика; измеримое изменение; ход времени; венозный.
© Американская ассоциация клинической химии, 2021 г. Все права защищены. Чтобы получить разрешения, отправьте электронное письмо по адресу: journals.permissions@oup.com.
Все права защищены. Чтобы получить разрешения, отправьте электронное письмо по адресу: journals.permissions@oup.com.
Похожие статьи
Стабильность образцов лактата цельной крови при комнатной температуре по сравнению с условиями на льду.
Заворский Г.С., Гаспарян С., Столленверк Н.С., Брукс Р.А.
Заворский Г.С. и соавт.
Уход за дыханием. 2021 март; 66 (3): 494-500. doi: 10.4187/respcare.08023. Epub 2020 1 сентября.
Уход за дыханием. 2021.PMID: 32873752
Техническое примечание: Влияние отсроченного анализа охлажденной цельной крови, обработанной гепарином лития, на стабильность ионизированного кальция, ионизированного магния, натрия, калия, хлорида, глюкозы и лактата в образцах от молочных коров.
Menta PR, Batchelder TA, Neves RC.

Menta PR и др.
Дж. Молочная наука. 2020 июнь;103(6):5509-5513. doi: 10.3168/jds.2019-17683. Epub 2020 16 апр.
Дж. Молочная наука. 2020.PMID: 32307153
Референтный интервал для ионизированного магния в цельной крови у здоровых людей и стабильность ионизированного магния в различных лабораторных условиях.
Гринуэй, округ Колумбия, Хиндмарш Дж.Т., Ван Дж., Ходадин Дж.А., Эберт П.С.
Гринуэй, округ Колумбия, и др.
Клин Биохим. 1996 декабря; 29 (6): 515-20. doi: 10.1016/s0009-9120(96)00091-4.
Клин Биохим. 1996.PMID: 8939398
Температурная и временная стабильность лактата цельной крови: значение для возможности догоспитального измерения.
Сеймур К.В., Карлбом Д., Кук К.Р., Уоткинс Т.Р., Балджер Э.


 1093/jalm/jfab089
1093/jalm/jfab089
 1093/jalm/jfab089
1093/jalm/jfab089