В идеальном тепловом двигателе абсолютная температура нагревателя в 3 раза выше, чем температурам холодильника. Найдите КПД двигателя
В идеальном тепловом двигателе абсолютная температура нагревателя в 3 раза выше, чем температурам холодильника. Найдите КПД двигателя (67%)
спросил
от
Вопросы и ответы
в категории Естественные науки
Ваш ответ
| Отображаемое имя (по желанию): |
Отправить мне письмо на это адрес если мой ответ выбран или прокомментирован:Отправить мне письмо если мой ответ выбран или прокомментирован |
Конфиденциальность: Ваш электронный адрес будет использоваться только для отправки уведомлений. |
| Анти-спам проверка: |
Чтобы избежать проверки в будущем, пожалуйста войдите или зарегистрируйтесь. |
1 Ответ
Похожие вопросы
В идеальной тепловой машине абсолютная температура нагревателя вдвое больше абсолютной температуры холодильника
спросил
от
Вопросы и ответы
в категории Естественные науки
Как изменится КПД идеальной тепловой машины, если абсолютную температуру нагревателя и холодильника увеличить вдвое?
спросил
от
Вопросы и ответы
в категории Естественные науки
Если в результате нагревания идеального газа его давление при постоянной концентрации увеличилась в 2 раза , то этом абсолютная температура газа
спросил
от
Вопросы и ответы
в категории Естественные науки
Тепловая машина за цикл от нагревателя получает количество теплоты 100 Дж и отдает холодильнику 75 Дж. КПД машины равен
КПД машины равен
спросил
от
Жауапбек
в категории Естественные науки
Чем выше температура стерилизации, тем:
спросил
от
Akma
в категории Тесты ЕНТ, КТА, ВОУД Ответы на тесты ЕНТ
Как нужно изменить объем газа для того, чтобы при постоянном давлении его температура уменьшилась в 3 раза?
спросил
от
Вопросы и ответы
в категории Естественные науки
Когда часть газа выпустили, температура газа в баллоне уменьшилась в 3 раза, а давление уменьшилось в 4 раза.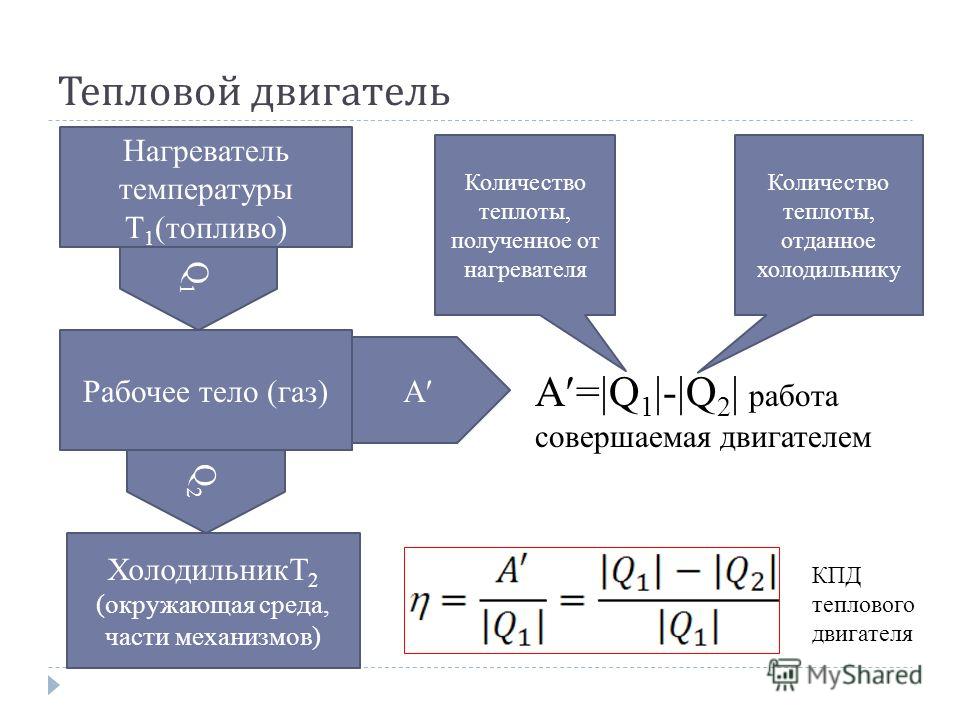 Какую часть газа выпустили?
Какую часть газа выпустили?
спросил
от
Вопросы и ответы
в категории Естественные науки
Абсолютная температура, соответствующая -20 С, равна
спросил
от
Жауапбек
в категории Естественные науки
В дизельном двигателе, при газотурбинном надуве, компрессор, подающий воздух в цилиндр двигателя, приводится в действие:
спросил
от
аноним
в категории Авто-Мото
Температура идеального газа при увеличении средней квадратичной скорости в 4 раза
спросил
от
Жауапбек
в категории Естественные науки
Природная зона, в которой температура равномерна, ночью выше +10°С, осадки выпадают регулярно, часты заболевания лихорадкой
спросил
от
Вопросы и ответы
в категории Школы
Если в идеальном колебательном контуре к конденсатору подключить параллельно конденсатора такой же емкости, то собственная частота колебаний в контуре
спросил
от
Вопросы и ответы
в категории Естественные науки
Почему для выращивания кормовых дрожжей на парафинах нефти нужно в 2-3 раза больше растворенного кислорода, чем при использовании другого субстрата:
спросил
от
Akma
в категории Тесты ЕНТ, КТА, ВОУД Ответы на тесты ЕНТ
Какая максимальная температура возникает в цилиндре дизельного двигателя?
спросил
от
аноним
в категории Авто-Мото
Определите физические параметры двух тел, которые обязательно должны быть для того, чтобы тела не находились в тепловом равновесии.
спросил
от
Вопросы и ответы
в категории Естественные науки
- Все категории
- Авто-Мото
834 - Бизнес, Финансы
1,651 - Праздники
46 - Города и Страны
1,224 - Досуг, Развлечения
449 - Еда, Кулинария
228 - Животные, Растения
5,986 - Знакомства, Любовь, Отношения
65 - Искусство и Культура
10,186 - Игры
265 - Кино
34 - Музыка
510 - Компьютеры, Связь
2,300 - Красота и Здоровье
1,092 - Наука, Техника, Языки
3,261- Гуманитарные науки
17 - Естественные науки
1,015 - Лингвистика
12 - Техника
19
- Гуманитарные науки
- Ұстаз
1,070 - Образование
6,729 - Общество, Политика, СМИ
1,739 - Юридическая консультация
142 - Путешествия, Туризм
99 - Работа, Карьера
96 - Казахские традиции
25 - Семья, Дом, Дети
176 - Спорт
100 - Стиль, Мода, Звезды
32 - Товары и Услуги
4,254 - Фотография, Видеосъемка
354 - Логические задачи
265 - Тесты ЕНТ, КТА, ВОУД Ответы на тесты ЕНТ
28,733 - Юмор
16 - Другое
14,168
Тепловые двигатели, цикл Карно, коэффициент полезного действия.
 Тест
Тест
Всего вопросов: 11
Вопрос 1. Газ, совершающий цикл Карно, 70% теплоты, полученной от нагревателя, отдает холодильнику. Температура нагревателя 430 К. Определите температуру (К) холодильника.
Вопрос 2. В результате циклического процесса газ совершил работу, равную 100 Дж и передал холодильнику 400 Дж теплоты. Определите КПД цикла.
Вопрос 3. Идеальная тепловая машина совершает за один цикл работу, равную 103 Дж. Чему равна равна температура холодильника, если температура нагревателя — 375К, максимальный КПД составляет 40%.
Вопрос 4. В идеальном тепловом двигателе абсолютная температура холодильника вдвое меньше температуры нагревателя. Если, не меняя температуры нагревателя, температуру холодильника понизить втрое, то во сколько раз увеличится КПД двигателя?
Вопрос 5. Идеальная тепловая машина, работающая по циклу Карно, получает от нагревателя с температурой 4930С количество теплоты 80 кДж. Холодильником является окружающий воздух с температурой 200С. На какую максимальную высоту эта машина может поднять груз массой 500 кг?
Холодильником является окружающий воздух с температурой 200С. На какую максимальную высоту эта машина может поднять груз массой 500 кг?
Вопрос 6. Абсолютная температура нагревателя идеального теплового двигателя в 3 раза выше температуры холодильника. Какое количество теплоты (кДж) получает рабочее тело от нагревателя, если за один цикл двигатель поднимает поршень массой 5 кг на высоту 20 м и сжимает при этом пружину жесткостью 625 кН/м на 8 см?
Вопрос 7. Идеальная холодильная машина, работающая по обратному циклу Карно, использует в качестве холодильника тающий лед при температуре 00С, а в качестве нагревателя – кипяток при 1000С. Холодильная машина получила от сети энергию 25 кДж. Определите массу (г) полученного льда, если удельная теплота плавления льда .
Вопрос 8. Тепловой двигатель, рабочим телом которого является идеальный газ, совершает цикл, изображенный на рисунке.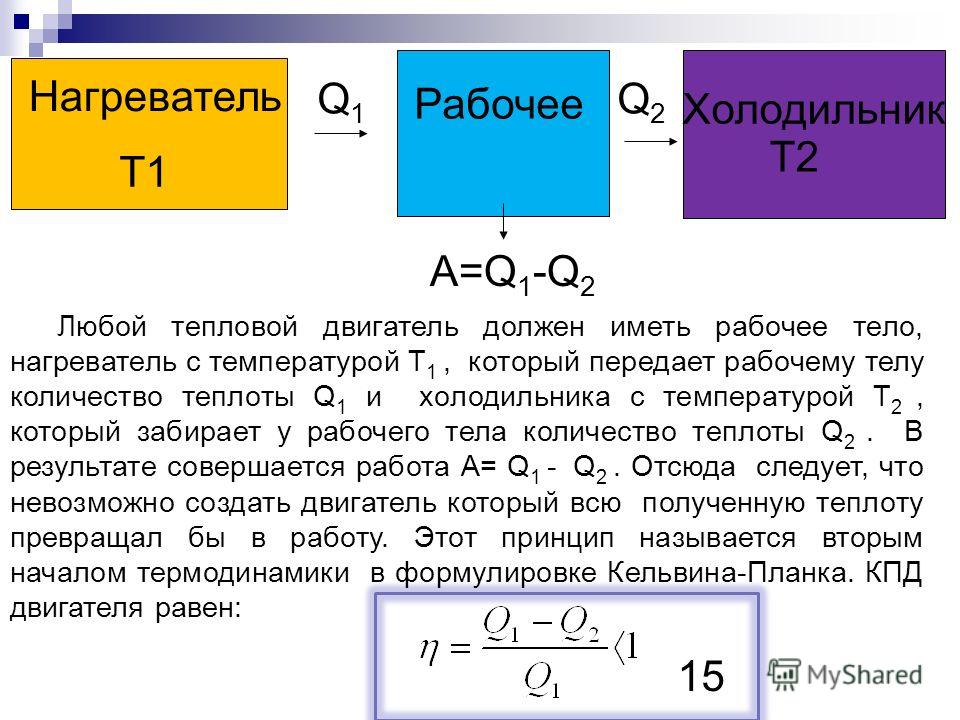 Определите КПД двигателя.
Определите КПД двигателя.
Вопрос 9. Один моль одноатомного газа совершает цикл, состоящий из двух изохор и двух изобар. При этом его максимальное давление в 2 раза больше минимального, а максимальный объем в 3 раза больше минимального. Определите КПД цикла.
Вопрос 10. Одноатомный идеальный газ совершает цикл, состоящий из двух адиабат и двух изохор. Если в процессе адиабатного расширения 1-2 температура газа T2=0,75T1, а в процессе адиабатного сжатия 3-4 температура газа T3=0,75T4. Определите КПД цикла.
Вопрос 11. КПД тепловой машины в цикле 1-2-3-1, состоящем из изотермы 1-2, изохоры 2-3 и адиабаты 3-1, равен 50%. В цикле 1-3-4-1, состоящем из адиабаты 1-3, изотермы 3-4 и изохоры 4-1, КПД 20%. Рабочим телом является одноатомный идеальный газ. Определите КПД тепловой машины, работающей по циклу 1-2-3-4-1.
12.2 Первый закон термодинамики: тепловая энергия и работа
Цели обученияДавление, объем, температура и закон идеального газаРабота давления–объемаПервый закон термодинамикиРешение задач, связанных с первым законом термодинамикиПрактические задачиПроверьте свое понимание
Цели обучения
К концу этого раздела вы сможете выполнять следующее:
- Опишите, как давление, объем и температура связаны друг с другом и работают на основе закона идеального газа
- Опишите работу давление-объем
- Опишите первый закон термодинамики словесно и математически
- Решить задачи, связанные с первым законом термодинамики
| Постоянная Больцмана | первый закон термодинамики | закон идеального газа |
| внутренняя энергия | давление |
Давление, объем, температура и закон идеального газа
Перед рассмотрением первого закона термодинамики важно понять связь между давлением, объемом и температурой. Давление, P , определяется как
12.1P=FA,P=FA,
где F — сила, приложенная к площади, A , которая перпендикулярна силе.
В зависимости от площади, на которую она воздействует, данная сила может иметь существенно разный эффект, как показано на рис. 12.3.
Рис. 12.3 (а) Хотя человек, которого тыкают пальцем, может испытывать раздражение, сила не имеет длительного эффекта. (b) Напротив, та же самая сила, приложенная к участку размером с острый конец иглы, достаточно велика, чтобы повредить кожу.
(b) Напротив, та же самая сила, приложенная к участку размером с острый конец иглы, достаточно велика, чтобы повредить кожу.
Единицей давления в СИ является паскаль , где 1 Па=1 Н/м2,1 Па=1 Н/м2.
Давление определяется для всех состояний вещества, но особенно важно при обсуждении жидкостей (например, воздуха). Вы, наверное, слышали слово давление используется по отношению к крови (высокое или низкое кровяное давление) и по отношению к погоде (погодные системы высокого и низкого давления). Это только два из многих примеров давлений в жидкостях.
Связь между давлением, объемом и температурой идеального газа определяется законом идеального газа. Газ считается идеальным при низком давлении и достаточно высокой температуре, и силами между составляющими его частицами можно пренебречь. Закон идеального газа гласит, что
12.2PV=NkT.PV=NkT.
, где P — давление газа, V — занимаемый им объем, N — число частиц (атомов или молекул) в газе, а T — его абсолютная температура. Константа k называется постоянной Больцмана и имеет значение k=1,38×10−23 Дж/К, k=1,38×10−23 Дж/К. В целях данной главы мы не будем вдаваться в расчеты с использованием идеальной газовый закон. Вместо этого нам важно заметить из уравнения, что для данной массы газа верно следующее:
Константа k называется постоянной Больцмана и имеет значение k=1,38×10−23 Дж/К, k=1,38×10−23 Дж/К. В целях данной главы мы не будем вдаваться в расчеты с использованием идеальной газовый закон. Вместо этого нам важно заметить из уравнения, что для данной массы газа верно следующее:
- Когда объем постоянный, давление прямо пропорционально температуре.
- Когда температура постоянна, давление обратно пропорционально объему.
- Когда давление постоянно, объем прямо пропорционален температуре.
Этот последний пункт описывает тепловое расширение — изменение размера или объема данной массы при изменении температуры. Что является основной причиной теплового расширения? Повышение температуры означает увеличение кинетической энергии отдельных атомов. Газы особенно подвержены тепловому расширению, хотя жидкости расширяются в меньшей степени при аналогичном повышении температуры, и даже твердые тела имеют незначительное расширение при более высоких температурах. Вот почему железнодорожные пути и мосты имеют компенсаторы, которые позволяют им свободно расширяться и сужаться при изменении температуры.
Вот почему железнодорожные пути и мосты имеют компенсаторы, которые позволяют им свободно расширяться и сужаться при изменении температуры.
Чтобы получить некоторое представление о том, как связаны друг с другом давление, температура и объем газа, представьте, что происходит, когда вы накачиваете воздух в спущенную шину. Объем шины сначала увеличивается прямо пропорционально количеству впрыскиваемого воздуха без значительного увеличения давления в шине. Как только шина расширяется почти до своего полного размера, стенки ограничивают объемное расширение. Если вы продолжите накачивать воздух в шину (которая теперь имеет почти постоянный объем), давление будет увеличиваться с повышением температуры (см. рис. 12.4).
Рисунок 12.4 (a) Когда воздух нагнетается в спущенную шину, ее объем сначала увеличивается без значительного увеличения давления. (b) Когда шина заполнена до определенной точки, стенки шины сопротивляются дальнейшему расширению, и давление увеличивается по мере добавления воздуха. (c) Когда шина полностью накачана, давление в ней увеличивается с температурой.
(c) Когда шина полностью накачана, давление в ней увеличивается с температурой.
Давление-Объем Работа
Работа давление-объем — это работа, совершаемая при сжатии или расширении жидкости. Всякий раз, когда происходит изменение объема, а внешнее давление остается постоянным, происходит работа давление-объем. При сжатии уменьшение объема увеличивает внутреннее давление в системе при совершении работы на систему. Во время расширения (рис. 12.5) увеличение объема уменьшает внутреннее давление в системе, поскольку система выполняет работу.
Рис. 12.5 Расширение газа требует передачи энергии для поддержания постоянного давления. Поскольку давление постоянно, совершаемая работа равна P∆VP∆V.
Напомним, что формула работы W=Fd.W=Fd. Мы можем изменить определение давления, P=FA,P=FA, чтобы получить выражение для силы через давление.
12. 3F=ПАФ=ПА
3F=ПАФ=ПА
Подставляя это выражение для силы в определение работы, получаем
12.4W=PAd.W=PAd.
Поскольку площадь, умноженная на перемещение, представляет собой изменение объема, W=P∆VW=P∆V, математическое выражение для работы давление-объем равно
.
12,5W=PΔV.W=PΔV.
Точно так же, как мы говорим, что работа — это сила, действующая на расстоянии, для жидкостей мы можем сказать, что работа — это давление, действующее через изменение объема. Для работы давление-объем давление аналогично силе, а объем аналогичен расстоянию в традиционном определении работы.
Watch Physics
Работа с расширением
В этом видео описывается работа с расширением (или работа давление-объем). Сал комбинирует уравнения W=P∆VW=P∆V и ∆U=Q-W∆U=Q-W, чтобы получить ∆U=Q-P∆V∆U=Q-P∆V.
Воспроизвести видео «Работа из дополнения».
Проверка захвата
Если объем системы увеличивается, а давление остается постоянным, является ли значение работы, выполненной системой Вт , положительной или отрицательной? Приведет ли это к увеличению или уменьшению внутренней энергии системы?
- Положительный; внутренняя энергия уменьшится
- Положительный; внутренняя энергия увеличится
- Отрицательный; внутренняя энергия уменьшится
- Отрицательный; внутренняя энергия увеличится
Первый закон термодинамики
Теплота ( Q ) и работа ( W ) — два способа добавления или удаления энергии из системы. Процессы очень разные. Тепло вызывается разницей температур, а работа связана с силой, действующей на расстоянии. Тем не менее, теплота и работа могут давать одинаковые результаты. Например, оба могут вызвать повышение температуры. Тепло передает энергию в систему, например, когда солнце нагревает воздух в велосипедной шине и повышает температуру воздуха. Точно так же над системой может совершаться работа, например, когда велосипедист накачивает воздух в шину. После того, как произошло повышение температуры, невозможно сказать, было ли оно вызвано теплом или работой. И теплота, и работа представляют собой энергию в пути — ни одна из них не хранится как таковая в системе. Однако оба могут изменять внутреннюю энергию, U , системы.
Процессы очень разные. Тепло вызывается разницей температур, а работа связана с силой, действующей на расстоянии. Тем не менее, теплота и работа могут давать одинаковые результаты. Например, оба могут вызвать повышение температуры. Тепло передает энергию в систему, например, когда солнце нагревает воздух в велосипедной шине и повышает температуру воздуха. Точно так же над системой может совершаться работа, например, когда велосипедист накачивает воздух в шину. После того, как произошло повышение температуры, невозможно сказать, было ли оно вызвано теплом или работой. И теплота, и работа представляют собой энергию в пути — ни одна из них не хранится как таковая в системе. Однако оба могут изменять внутреннюю энергию, U , системы.
Внутренняя энергия представляет собой сумму кинетической и потенциальной энергий атомов и молекул системы. Ее можно разделить на множество подкатегорий, таких как тепловая и химическая энергия, и она зависит только от состояния системы (т.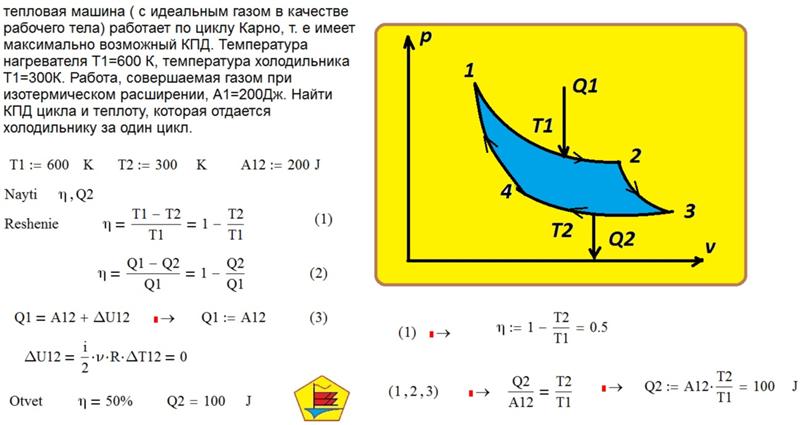 система.
система.
Чтобы понять взаимосвязь между теплотой, работой и внутренней энергией, мы используем первый закон термодинамики. Первый закон термодинамики применяет принцип сохранения энергии к системам, в которых теплота и работа являются методами передачи энергии в системы и из них. Его также можно использовать для описания того, как энергия, передаваемая теплом, преобразуется и снова передается за счет работы.
Советы для достижения успеха
Вспомним, что принцип сохранения энергии гласит, что энергия не может быть создана или уничтожена, но может быть преобразована из одной формы в другую.
Первый закон термодинамики гласит, что изменение внутренней энергии замкнутой системы равно чистой передаче тепла в систему минус сетевая работа, выполненная на систему. В форме уравнения первый закон термодинамики равен
.
12,6ΔU=Q−W.ΔU=Q−W.
Здесь ΔUΔU — изменение внутренней энергии , U , системы. Как показано на рис. 12.6, Q — это чистого тепла, переданного в систему , т. е. Q — это сумма всех теплопередач в систему и из нее. W — чистая работа, выполненная системой — то есть W — это сумма всей работы, проделанной системой или над ней. По соглашению, если Q положительное, то в систему имеет место чистый перенос тепла; если W положительно, то система выполняет чистую работу. Таким образом, положительный Q добавляет в систему энергию за счет тепла, а положительный W забирает энергию из системы за счет работы. Обратите внимание, что если тепло передает в систему больше энергии, чем та, которая совершается за счет работы, разница запасается в виде внутренней энергии.
Как показано на рис. 12.6, Q — это чистого тепла, переданного в систему , т. е. Q — это сумма всех теплопередач в систему и из нее. W — чистая работа, выполненная системой — то есть W — это сумма всей работы, проделанной системой или над ней. По соглашению, если Q положительное, то в систему имеет место чистый перенос тепла; если W положительно, то система выполняет чистую работу. Таким образом, положительный Q добавляет в систему энергию за счет тепла, а положительный W забирает энергию из системы за счет работы. Обратите внимание, что если тепло передает в систему больше энергии, чем та, которая совершается за счет работы, разница запасается в виде внутренней энергии.
Рис. 12.6 Первый закон термодинамики — это принцип сохранения энергии , сформулированный для системы, где теплота и работа — это методы передачи энергии в систему и из нее. Q представляет чистую теплопередачу — это сумма всех передач энергии в виде тепла в систему и из нее. Q положителен для полезного теплопереноса в систему. WoutWout — это работа, проделанная системой, а WinWin — это проделанная работа на систему. W — это общая работа, выполненная в системе или на . W является положительным, когда на системе выполняется больше работы, чем на ей. Изменение внутренней энергии системы ΔUΔU связано с выделением тепла и работой согласно первому закону термодинамики: ΔU=Q−W. ΔU=Q−W.
ΔU=Q−W.
Из этого также следует, что отрицательный Q указывает на то, что энергия передается от системы за счет тепла и, таким образом, уменьшает внутреннюю энергию системы, тогда как отрицательный W это работа над системой, увеличивающая внутреннюю энергию.
Watch Physics
Первый закон термодинамики/Внутренняя энергия
В этом видео объясняется первый закон термодинамики, сохранение энергии и внутренняя энергия. В нем рассматривается пример преобразования энергии между кинетической энергией, потенциальной энергией и теплопередачей из-за сопротивления воздуха.
Воспроизвести видео «Первый закон термодинамики».
Проверка захвата
Рассмотрим пример подбрасывания мяча при наличии сопротивления воздуха. Что, по вашему мнению, произойдет с конечной скоростью и конечной кинетической энергией мяча по мере увеличения сопротивления воздуха? Почему?
- Оба будут уменьшаться.
 Энергия передается воздуху за счет тепла из-за сопротивления воздуха.
Энергия передается воздуху за счет тепла из-за сопротивления воздуха. - Оба увеличатся. Энергия передается от воздуха к мячу за счет сопротивления воздуха.
- Конечная скорость увеличится, но конечная кинетическая энергия уменьшится. Энергия передается в виде тепла воздуху от мяча за счет сопротивления воздуха.
- Конечная скорость уменьшится, но конечная кинетическая энергия увеличится. Энергия передается теплом от воздуха к мячу за счет сопротивления воздуха.
Смотреть физику
Подробнее о внутренней энергии
В этом видео более подробно рассказывается о внутренней энергии и о том, как использовать уравнение ΔU=Q−W.ΔU=Q−W. Обратите внимание, что Сал использует уравнение ΔU=Q+WΔU=Q+W , где W — это работа, выполненная на системе, тогда как мы используем W для представления работы, выполненной системой .
Проиграть видео «Внутренняя энергия».
Проверка захвата
Если 5 Дж отводится теплом из системы, и система совершает 5 Дж работы, как изменится внутренняя энергия системы?
- −10 Дж
- 0Дж
- 10Дж
- 25Дж
Решение задач, связанных с первым законом термодинамики
Рабочий пример
Расчет изменения внутренней энергии
Предположим, что 40,00 Дж энергии передается системе в виде тепла, а система совершает 10,00 Дж работы. Далее из системы передается 25,00 Дж теплоты, а за счет работы над системой совершается 4,00 Дж. Каково чистое изменение внутренней энергии системы?
СТРАТЕГИЯ
Сначала необходимо рассчитать полезное тепло и чистую работу. Затем, используя первый закон термодинамики ΔU=Q−W, ΔU=Q−W, найдите изменение внутренней энергии.
Решение
Чистая теплота представляет собой передачу тепла в систему минус передачу тепла из системы, или
12,7Q=40,00 Дж-25,00 Дж=15,00 Дж. Q=40,00 Дж-25,00 Дж=15,00 Дж.
Q=40,00 Дж-25,00 Дж=15,00 Дж.
Полная работа – это работа, выполненная системой, за вычетом работы, выполненной над системой, или определяется первым законом термодинамики.
12,9ΔU=Q−W=15,00 Дж−6,00 Дж=9,00 ДжΔU=Q−W=15,00 Дж−6,00 Дж=9.00 Дж
Обсуждение
Другой способ решения этой задачи состоит в том, чтобы найти изменение внутренней энергии для каждого из двух шагов в отдельности, а затем сложить два изменения, чтобы получить общее изменение внутренней энергии. Этот подход будет выглядеть следующим образом:
Для 40,00 Дж тепла и 10,00 Дж работы изменение внутренней энергии составляет W1=40,00 Дж−10,00 Дж=30,00 Дж.
Для 25,00 Дж тепловыделения и 4,00 Дж работы изменения внутренней энергии равно
12,11ΔU2=Q2-W2=-25,00 Дж-(-4,00 Дж)=-21,00 Дж. ΔU2=Q2-W2=-25,00 Дж-(-4,00 Дж)=-21,00 Дж.
Общее изменение равно
12,12ΔU=ΔU1+ΔU2=30,00 Дж+(−21,00 Дж)=9,00 Дж.ΔU=ΔU1+ΔU2=30,00 Дж+(−21,00 Дж)=9,00 Дж. на ступени изменение внутренней энергии одинаково.
Рабочий пример
Расчет изменения внутренней энергии: одно и то же изменение в
U производится двумя разными процессами
Как изменится внутренняя энергия системы, если в общей сложности 150,00 Дж передано теплотой от системы и 159,00 Дж произведена работой над системой?
СТРАТЕГИЯ
Чистое тепло и работа уже даны, поэтому просто используйте эти значения в уравнении ΔU=Q−W.ΔU=Q−W.
Решение
Здесь чистая теплота и полная работа задаются непосредственно как Q=-150,00 Дж и W=-159,00 Дж, Q=-150,00 Дж и W=-159,00 Дж, так что
12,13ΔU=Q- Вт=-150,00 Дж-(-1590,00 Дж)=9,00 Дж.ΔU=Q-W=-150,00 Дж-(-159,00 Дж)=9,00 Дж.
Обсуждение
Рис. 12.8 Два разных процесса вызывают одно и то же изменение в системе. (а) Всего в систему поступает 15,00 Дж теплоты, а работа отнимает всего 6,00 Дж. Изменение внутренней энергии равно ΔU = Q – W = 9,00 Дж. (б) Теплопередачей отводится 150,00 Дж из система при работе вкладывает в нее 159,00 Дж, производя увеличение внутренней энергии на 9,00 Дж.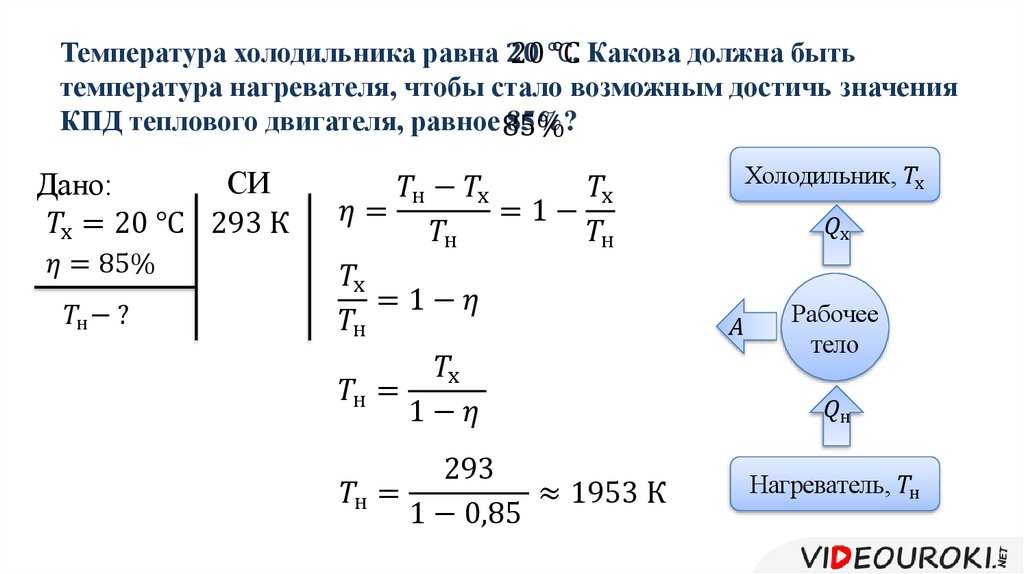 Если система начинается в одном и том же состоянии в (а) и (б), она в конечном итоге окажется в одном и том же конечном состоянии в любом случае — ее конечное состояние связано с внутренней энергией, а не с тем, как эта энергия была приобретена.
Если система начинается в одном и том же состоянии в (а) и (б), она в конечном итоге окажется в одном и том же конечном состоянии в любом случае — ее конечное состояние связано с внутренней энергией, а не с тем, как эта энергия была приобретена.
Совершенно другой процесс во втором рабочем примере приводит к тому же изменению внутренней энергии на 9,00 Дж, что и в первом рабочем примере. Обратите внимание, что изменение в системе в обеих частях связано с ΔUΔU, а не с отдельными задействованными Q или W . Система оказывается в том же состоянии в обеих задачах. Обратите внимание, что, как обычно, на рис. 12.8 выше WoutWout — это работа, выполненная на системе, а WinWin — это работа, выполненная на системе.
Практические задачи
Какова работа давление-объем, совершаемая системой, если давление 20 Па вызывает изменение объема 3,0 м3?
- 0,15 Дж
- 6,7 Дж
- 23Дж
- 60Дж
Чему равно тепло, выделяемое системой, если 25 Дж передается теплом в систему, а 45 Дж выходит из нее?
- −70 Дж
- −20J
- 20Дж
- 70Дж
Проверьте свое понимание
Упражнение 3
Что такое давление?
- Давление равно силе, деленной на длину.

- Давление — это сила, деленная на площадь.
- Давление равно силе, деленной на объем.
- Давление — это сила, деленная на массу.
Упражнение 4
Что такое единица СИ для давления?
- паскалей или Н/м 3
- кулон
- ньютон
- паскалей или Н/м 2
Упражнение 5
Что такое работа давление-объем?
- Работа, совершаемая при сжатии или расширении жидкости.
- Это работа, совершаемая силой над объектом для получения определенного перемещения.
- Это работа, которую совершают поверхностные молекулы жидкости.
- Это работа, которую совершают высокоэнергетические молекулы жидкости.

Упражнение 6
Когда считается, что работа давление-объем совершается В системе?
- При увеличении как объема, так и внутреннего давления.
- При снижении как объема, так и внутреннего давления.
- При снижении объема и повышении внутреннего давления.
- При увеличении объема и снижении внутреннего давления.
Упражнение 7
Какими способами можно добавить или убрать энергию из системы?
- Передача энергии с помощью тепла — единственный способ добавления энергии в систему или удаления энергии из нее.
- Выполнение работы сжатия — единственный способ добавить энергию в систему или убрать ее из системы.
- Выполнение работ по расширению — единственный способ добавить или убрать энергию из системы.
- Передача энергии с помощью тепла или выполнения работы — это способы добавления энергии в систему или удаления энергии из нее.

Упражнение 8
Что такое внутренняя энергия?
- Это сумма кинетических энергий атомов и молекул системы.
- Это сумма потенциальных энергий атомов и молекул системы.
- Это сумма кинетической и потенциальной энергий атомов и молекул системы.
- Это разница между величинами кинетической и потенциальной энергии атомов и молекул системы.
- Печать
- Поделиться
термодинамика — Почему нагрев помещения на заданный градус зависит от абсолютной температуры?
Задать вопрос
спросил
Изменено
6 лет, 5 месяцев назад
Просмотрено
134 раза
$\begingroup$
Я изучаю коэффициент полезного действия (COP) и пытаюсь понять его значение для отопления/охлаждения.
Интуитивно я предположил, что для нагрева или охлаждения комнаты на заданную величину требуется одинаковое количество энергии независимо от абсолютной температуры. Например, зависит ли количество энергии, используемой для обогрева/охлаждения комнаты на 1°C, от ее абсолютной температуры (например, 20°C против 22°C)?
Максимальный теоретический COP нагрева составляет
$COP_{heating} = \frac{T_{hot}}{T_{hot} — T_{cool}}$
, где температура указана в градусах Кельвина.
Таким образом, COP для повышения температуры с 20°C до 21°C составляет
29 долларов США.4,15 = \frac{(21 + 273,15)}{ (21 + 273,15) — (20 + 273,15) }$
, а COP повышения температуры с 22°C до 23°C составляет
$296,15 = \frac{(23 + 273,15)}{ (23 + 273,15) — (22 + 273,15) }$
Итак, похоже, мое предположение было неверным. Каково интуитивное объяснение того, почему это так? Если это неправильно, то почему?
- термодинамика
$\endgroup$
3
$\begingroup$
Давайте попробуем в логических, не технических терминах. Когда вы пытаетесь поднять температуру в комнате на один градус, вы повышаете уровень энергии в комнате. Если начальное состояние ниже, для этого потребуется меньше общих усилий, чем если бы начальное состояние уже было высоким. Хотя эта разница может быть небольшой при попытке поднять температуру на один градус и сравнении начальных значений 20°C и 21°C, она очень заметна при сравнении начальных значений 20°C и 500°C.
Когда вы пытаетесь поднять температуру в комнате на один градус, вы повышаете уровень энергии в комнате. Если начальное состояние ниже, для этого потребуется меньше общих усилий, чем если бы начальное состояние уже было высоким. Хотя эта разница может быть небольшой при попытке поднять температуру на один градус и сравнении начальных значений 20°C и 21°C, она очень заметна при сравнении начальных значений 20°C и 500°C.
Подумайте об этом с точки зрения автомобиля. Чтобы разогнать автомобиль с 20 до 21 мили в час, требуется гораздо меньше усилий, чем для того, чтобы разогнать его со 100 до 101 мили в час, даже если это такое же увеличение на 1 милю в час. Вы не просто добавляете 1 милю в час к скорости или 1 градус к температуре, вы увеличиваете общее энергетическое состояние системы, которое становится экспоненциальной функцией, а не линейной.
$\endgroup$
$\begingroup$
Цикл Карно здесь особенно важен. Теорема Карно гласит: «Любой цикл [двигатель], работающий между температурами Th и Tc, никогда не превысит эффективность цикла Карно. Эффективность CC = W/Qh = 1 — Tc/Th = (Th-Tc)/Th. Вывод эффективности можно найти в Википедии https://en.wikipedia.org/wiki/Carnot_cycle, а также 4 этапа цикла.Дополнительную информацию можно найти в различных термодинамических темах, энергии, энтропии, температуре, Изотермические, обратимые адиабиатические (= изоэнтропические) и т. д. Вы заметите взаимосвязь между термодинамической эффективностью и КПД… Что касается вашей интуиции, я бы предложил взглянуть на основные термодинамические циклы Карно, Ренкина. , Стирлинга, Дизеля, Отто и отметив, что они (особенно цикл Карно) включают энтропию, а энтропия основана на абсолютном нуле.Вы не ошибаетесь, что энергия, содержащаяся в объеме (идеального газа), зависит только от температуры ( в равновесии, конечно), но dE = dQ-dW = TdS-dW, что означает, что у вас есть t o пренебречь работой (dW), чтобы получить соотношение, в котором изменение энергии пропорционально изменению температуры.
Теорема Карно гласит: «Любой цикл [двигатель], работающий между температурами Th и Tc, никогда не превысит эффективность цикла Карно. Эффективность CC = W/Qh = 1 — Tc/Th = (Th-Tc)/Th. Вывод эффективности можно найти в Википедии https://en.wikipedia.org/wiki/Carnot_cycle, а также 4 этапа цикла.Дополнительную информацию можно найти в различных термодинамических темах, энергии, энтропии, температуре, Изотермические, обратимые адиабиатические (= изоэнтропические) и т. д. Вы заметите взаимосвязь между термодинамической эффективностью и КПД… Что касается вашей интуиции, я бы предложил взглянуть на основные термодинамические циклы Карно, Ренкина. , Стирлинга, Дизеля, Отто и отметив, что они (особенно цикл Карно) включают энтропию, а энтропия основана на абсолютном нуле.Вы не ошибаетесь, что энергия, содержащаяся в объеме (идеального газа), зависит только от температуры ( в равновесии, конечно), но dE = dQ-dW = TdS-dW, что означает, что у вас есть t o пренебречь работой (dW), чтобы получить соотношение, в котором изменение энергии пропорционально изменению температуры.

 Энергия передается воздуху за счет тепла из-за сопротивления воздуха.
Энергия передается воздуху за счет тепла из-за сопротивления воздуха.

