Вопрос: Какая физическая величина характеризует экономичность двигателя? Ответ на вопрос – iq2u
Точные науки
Физика
Ответ:
Коэффициент полезного действия двигателя.
Что? Где? Когда? Эрудит онлайн: ответы на
вопросы:
- Какая из ситуаций является административным правонарушением?
- Какая карта дает представление об особенностях циркуляции атмосферы в ближайшие дни?
- Какая низменность наиболее заселена и освоена?
- Какая гора Евразии самая высокая?
- Какая биологическая наука занимается классификацией организмов по группам на основе их сходства и родства?
- Какая страна Евразии самая многонациональная?
- Какая жидкость — духи, вода, подсолнечное масло — испарится быстрее других?
- Какая из мировых религий зародилась у племен Аравийского полуострова и связана с деятельностью пророка Мухаммеда?
- Какая река бассейна Индийского океана самая крупная?
- Какая из российских рек является крупнейшей в Европе?
- Какая страна находится на Пиренейском полуострове?
- Какая физическая величина имеет единицу 1 тесла?
- Какая страна зарубежной Европы самая большая по численности населения?
- Какая река полноводна круглый год?
- Какая ткань состоит из вытянутых клеток?
Тепловые двигатели — Физика — Презентации
Работа пара и газа при расширении. КПД теплового двигателя
КПД теплового двигателя
Физика, 8 класс
Вперёд
Автор – Иванов Виктор Васильевич, МБОУ «СОШ с.Вязовка» Черноярского района Астраханской области, 2018 г.
1. Как изменяется внутренняя энергия пара или газа при расширении? Изменение какой физической величины свидетельствует об этом?
Жаль, ошибка…
Уменьшается; массы
Увеличивается; температуры
Подумай…
Уменьшается; температуры
Правильно!
Неверно…
Увеличивается; мощности
Вперёд
2. Машины, в которых внутренняя энергия топлива превращается во внутреннюю энергию газа или пара, а затем в механическую энергию, называют…
Неверно…
гидравлическими машинами
тепловыми двигателями
Правильно!
Жаль, ошибка…
простыми механизмами
Вперёд
3. Какой тепловой двигатель называют двигателем внутреннего сгорания?
Какой тепловой двигатель называют двигателем внутреннего сгорания?
Подумай…
Который имеет внутреннюю камеру сгорания топлива
У которого топливо сгорает внутри рабочего цилиндра двигателя
Правильно!
Для которого используется жидкое топливо, вводимое непосредственно в двигатель
Жаль, ошибка…
Вперёд
4. Из последовательности каких четырех тактов состоит каждый цикл работы двигателя внутреннего сгорания?
1 Впуск, расширение, воспламенение, рабочий ход
Неверно…
2 Впуск, сжатие, воспламенение, выпуск
Подумай…
3 Впуск, воспламенение, рабочий ход, выпуск
Жаль, ошибка…
4 Впуск, сжатие, рабочий ход, выпуск
Правильно!
Вперёд
5. Зачем для работы четырехтактного двигателя внутреннего сгорания нужен маховик на его валу?
Чтобы маховик во время рабочего хода запасал энергию, нужную для работы двигателя внутреннего сгорания
Жаль, ошибка…
Чтобы маховик вращал вал двигателя в интервалах времени между рабочими ходами
Неверно…
Чтобы, получив энергию во время рабочего хода и вращаясь затем по инерции, маховик поворачивал вал двигателя для осуществления других тактов цикла его работы
Правильно!
Вперёд
6. Паровая (газовая) турбина — вид теплового двигателя
Паровая (газовая) турбина — вид теплового двигателя
приводимого в движение струями пара (газа), давящими на лопатки дисков, находящихся на его валу
Жаль, ошибка…
Подумай…
отличающегося от двигателя внутреннего сгорания тем, что может работать на любом топливе
Неверно…
без поршня и системы зажигания топлива
для которого характерны все пункты 1,2,3
Правильно!
Вперёд
7. Наличие каких составных частей обязательно для работы теплового двигателя?
Неверно…
Рабочего тела — пара или газа
Камера сгорания топлива или парового котла с топкой
Подумай…
Отвода отработанного пара или газа
Жаль, ошибка…
Нагревателя, рабочего тела, холодильника
Правильно!
Вперёд
8. Какая физическая величина характеризует экономичность двигателя?
Произведенная двигателем механическая работа
Подумай…
Его мощность
Жаль, ошибка…
Коэффициент полезного действия двигателя
Правильно!
Количество теплоты, полученное при сгорании топлива
Неверно…
Вперёд
9. Коэффициент полезного действия — это физическая величина, равная
Коэффициент полезного действия — это физическая величина, равная
Подумай…
совершенной двигателем полезной работе
отношению произведенной двигателем полезной работы к полученной от нагревателя энергии
Правильно!
количеству теплоты, выделенной при сгорании топлива
Неверно…
Вперёд
10. По каким формулам находят коэффициент полезного действия теплового двигателя?
Жаль, ошибка…
1
2
Неверно…
3
4
Правильно!
Вперёд
12. Почему (указать главную причину) КПД теплового двигателя не может быть равен 100%?
Потому что пар (газ) отдает в тепловом двигателе только часть своей внутренней энергии и должен быть отведен в холодильник, чтобы новая порция пара могла произвести работу
Правильно!
Потому что всегда существует трение в движущихся деталях двигателя
Неверно…
Жаль, ошибка…
Потому что часть количества теплоты, выделяющегося при сгорании топлива, теряется — передается окружающим нагреватель телам
Вперёд
Подведём итоги работы
Перейди на первый вопрос.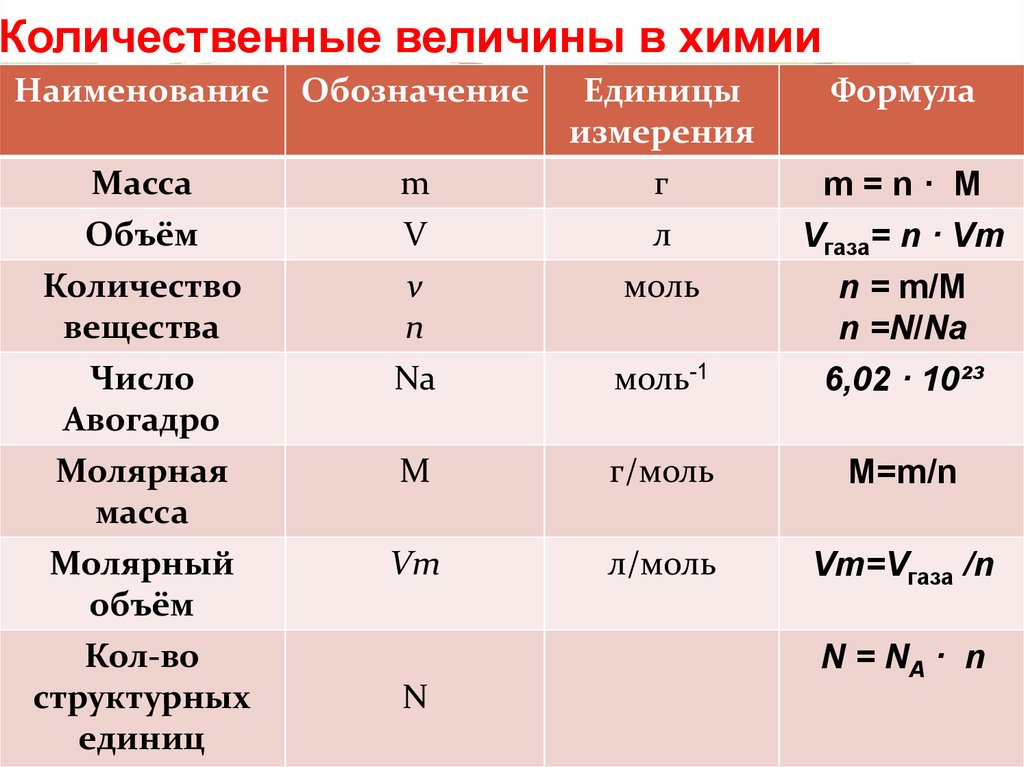 Посмотри, есть ли ошибки. Далее переходи по всем слайдам и складывай допущенные ошибки.
Посмотри, есть ли ошибки. Далее переходи по всем слайдам и складывай допущенные ошибки.
Если ошибок меньше 3 , то оценка « 5 ».
Если от 3 до 4 , оценка « 4 ».
Если от 5 до 6 , оценка « 3 ».
Если больше 6 , оценка « 2 ».
Проверка
Выход
15.3 Введение во второй закон термодинамики: тепловые двигатели и их эффективность — College Physics 2e
Цели обучения
К концу этого раздела вы сможете:
- Назовите выражения второго начала термодинамики.
- Рассчитайте КПД и выбросы углекислого газа угольной электростанции, используя характеристики второго закона.
- Опишите и дайте определение циклу Отто.
Рисунок
15.14
Эти льдины тают во время арктического лета. Некоторые из них замерзают зимой, но второй закон термодинамики предсказывает, что молекулам воды, содержащимся в этих конкретных льдинах, крайне маловероятно, чтобы они преобразовали характерную аллигатороподобную форму, которую они сформировали, когда снимок был сделан летом 2009 года. (Источник: Патрик Келли, Береговая охрана США, Геологическая служба США)
(Источник: Патрик Келли, Береговая охрана США, Геологическая служба США)
Второй закон термодинамики касается направления самопроизвольных процессов. Многие процессы протекают самопроизвольно только в одном направлении, т. е. необратимы при данном наборе условий. Хотя необратимость наблюдается в повседневной жизни — например, разбитое стекло не возвращается в исходное состояние — полная необратимость — это статистическое утверждение, которое нельзя увидеть в течение жизни Вселенной. Точнее, необратимый процесс — это процесс, зависящий от пути. Если процесс может идти только в одном направлении, то обратный путь принципиально иной и процесс не может быть обратимым. Например, как отмечалось в предыдущем разделе, теплота включает передачу энергии от более высокой температуры к более низкой. Холодный объект при соприкосновении с горячим никогда не становится холоднее, передавая тепло горячему объекту и делая его горячее. Кроме того, механическая энергия, например кинетическая энергия, может быть полностью преобразована в тепловую энергию трения, но обратное невозможно. Горячий неподвижный объект никогда самопроизвольно не остывает и не приходит в движение. Еще одним примером является расширение струи газа, введенной в один из углов вакуумной камеры. Газ расширяется, заполняя камеру, но никогда не собирается в углу. Беспорядочное движение молекул газа могло бы привести их всех обратно в угол, но этого никогда не происходит. (См. рис. 15.15.)
Горячий неподвижный объект никогда самопроизвольно не остывает и не приходит в движение. Еще одним примером является расширение струи газа, введенной в один из углов вакуумной камеры. Газ расширяется, заполняя камеру, но никогда не собирается в углу. Беспорядочное движение молекул газа могло бы привести их всех обратно в угол, но этого никогда не происходит. (См. рис. 15.15.)
Рисунок
15.15
Примеры односторонних процессов в природе. а) Теплопередача происходит самопроизвольно от горячего к холодному, а не от холодного к горячему. (b) Тормоза этого автомобиля преобразуют его кинетическую энергию в передачу тепла окружающей среде. Обратный процесс невозможен. (c) Выброс газа, впущенного в эту вакуумную камеру, быстро расширяется, чтобы равномерно заполнить все части камеры. Беспорядочные движения молекул газа никогда не вернут их в угол.
Тот факт, что некоторые процессы никогда не происходят, говорит о том, что существует закон, запрещающий их осуществление. Первый закон термодинамики допускает их возникновение — ни один из этих процессов не нарушает закон сохранения энергии. Закон, запрещающий эти процессы, называется вторым законом термодинамики. Мы увидим, что второй закон можно сформулировать разными способами, которые могут показаться разными, но на самом деле они эквивалентны. Как и все законы природы, второй закон термодинамики дает представление о природе, и несколько его утверждений подразумевают, что он широко применим, коренным образом влияя на многие, казалось бы, несопоставимые процессы.
Первый закон термодинамики допускает их возникновение — ни один из этих процессов не нарушает закон сохранения энергии. Закон, запрещающий эти процессы, называется вторым законом термодинамики. Мы увидим, что второй закон можно сформулировать разными способами, которые могут показаться разными, но на самом деле они эквивалентны. Как и все законы природы, второй закон термодинамики дает представление о природе, и несколько его утверждений подразумевают, что он широко применим, коренным образом влияя на многие, казалось бы, несопоставимые процессы.
Уже знакомое нам направление теплопередачи от горячего к холодному лежит в основе нашей первой версии второго закона термодинамики.
Второй закон термодинамики (первое выражение)
Теплопередача происходит самопроизвольно от тел с более высокой температурой к телам с более низкой температурой, но никогда самопроизвольно в обратном направлении.
Другой способ сформулировать это: ни один процесс не может иметь своим единственным результатом передачу тепла от более холодного объекта к более горячему.
Тепловые двигатели
Теперь давайте рассмотрим устройство, которое использует теплопередачу для выполнения работы. Как отмечалось в предыдущем разделе, такое устройство называется тепловым двигателем, и оно схематически показано на рис. 15.16(b). Бензиновые и дизельные двигатели, реактивные двигатели и паровые турбины — все это тепловые двигатели, которые работают, используя часть теплопередачи из какого-либо источника. Теплоотдача от горячего тела (или горячего резервуара) обозначается как QhQh, теплопередача в холодный предмет (или холодный резервуар) – QcQc, а работа, совершаемая двигателем, – WW. Температуры горячего и холодного резервуаров равны ThTh и TcTc соответственно.
Рисунок
15.16
а) Теплопередача происходит самопроизвольно от горячего тела к холодному в соответствии со вторым законом термодинамики. б) Тепловая машина, представленная здесь кружком, использует часть теплопередачи для совершения работы. Горячие и холодные объекты называются горячими и холодными резервуарами. QhQh — теплоотдача из горячего резервуара, WW — работа, QcQc — теплоотдача в холодный резервуар.
QhQh — теплоотдача из горячего резервуара, WW — работа, QcQc — теплоотдача в холодный резервуар.
Поскольку горячий резервуар нагревается снаружи, что требует больших затрат энергии, важно, чтобы работа выполнялась максимально эффективно. На самом деле хотелось бы, чтобы WW было равно QhQh, и чтобы не было передачи тепла в окружающую среду (Qc=0Qc=0). К сожалению, это невозможно. Второй закон термодинамики также утверждает относительно использования теплопередачи для совершения работы (второе выражение второго закона):
Второй закон термодинамики (второе выражение)
Ни в одной системе теплопередачи от резервуара невозможно полное преобразование в работу в циклическом процессе, при котором система возвращается в исходное состояние.
Циклический процесс возвращает систему, например газ в баллоне, в исходное состояние в конце каждого цикла. В большинстве тепловых двигателей, таких как поршневые двигатели и вращающиеся турбины, используются циклические процессы. Второй закон, только что изложенный в его второй форме, ясно утверждает, что такие двигатели не могут иметь совершенного преобразования теплопередачи в совершенную работу. Прежде чем перейти к основным причинам ограничений на преобразование теплопередачи в работу, нам необходимо изучить взаимосвязь между WW, QhQh и QcQc и определить эффективность циклической тепловой машины. Как уже отмечалось, циклический процесс возвращает систему в исходное состояние в конце каждого цикла. Внутренняя энергия такой системы UU одинакова в начале и в конце каждого цикла, то есть ΔU=0ΔU=0. Первый закон термодинамики гласит, что
Второй закон, только что изложенный в его второй форме, ясно утверждает, что такие двигатели не могут иметь совершенного преобразования теплопередачи в совершенную работу. Прежде чем перейти к основным причинам ограничений на преобразование теплопередачи в работу, нам необходимо изучить взаимосвязь между WW, QhQh и QcQc и определить эффективность циклической тепловой машины. Как уже отмечалось, циклический процесс возвращает систему в исходное состояние в конце каждого цикла. Внутренняя энергия такой системы UU одинакова в начале и в конце каждого цикла, то есть ΔU=0ΔU=0. Первый закон термодинамики гласит, что
ΔU=Q-W, ΔU=Q-W,
15,22
, где QQ — чистая теплопередача во время цикла (Q=Qh−QcQ=Qh−Qc), а WW — чистая работа, выполненная системой. Поскольку ΔU=0ΔU=0 для полного цикла, имеем
0=Q−W,0=Q−W,
15,23
так что
В=Q.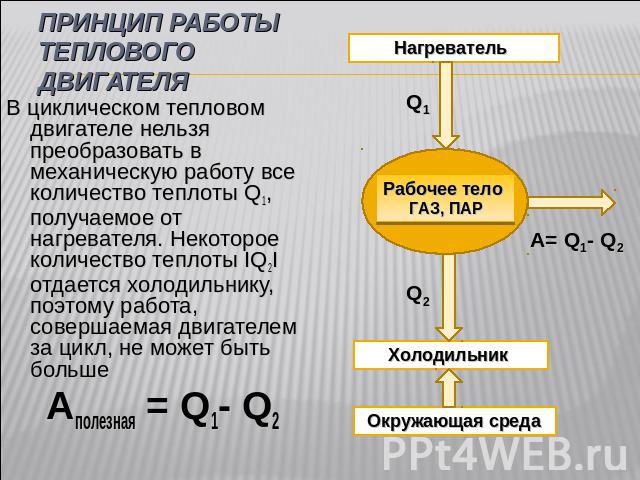 W=Q.
W=Q.
15,24
Таким образом, чистая работа, совершаемая системой, равна чистой передаче тепла в систему, или
W=Qh-Qc(циклический процесс),W=Qh-Qc(циклический процесс),
15,25
, как схематично показано на рис. 15.16(b). Проблема в том, что во всех процессах происходит некоторая теплопередача QcQc в окружающую среду, и обычно очень значительная.
При преобразовании энергии в работу мы всегда сталкиваемся с проблемой того, что получаем меньше, чем вкладываем. Мы определяем КПД преобразования EffEff как отношение выхода полезной работы к подводимой энергии (или, другими словами, словами, отношение того, что мы получаем, к тому, что мы тратим). В этом духе мы определяем КПД тепловой машины как его чистую выходную мощность WW, деленную на теплопередачу двигателю QhQh; то есть
Эфф=WQч.Эфф=WQч.
15,26
Поскольку W=Qh-QcW=Qh-Qc в циклическом процессе, мы также можем выразить это как
Eff=Qh-QcQh=1-QcQh(циклический процесс),Eff=Qh-QcQh=1-QcQh(циклический процесс),
15,27
поясняя, что эффективность 1 или 100% возможна только если нет передачи тепла в окружающую среду (Qc=0Qc=0). Обратите внимание, что все QQ положительны. Направление теплопередачи указывается знаком плюс или минус. Например, QcQc находится вне системы, поэтому ему предшествует знак минус.
Обратите внимание, что все QQ положительны. Направление теплопередачи указывается знаком плюс или минус. Например, QcQc находится вне системы, поэтому ему предшествует знак минус.
Пример
15,3
Ежедневная работа угольной электростанции, ее эффективность и выбросы углекислого газа
Угольная электростанция представляет собой огромную тепловую машину. Он использует теплопередачу от сжигания угля для выполнения работы по вращению турбин, которые используются для выработки электроэнергии. За один день крупная угольная электростанция имеет 2,50×1014J2,50×1014Дж теплоотдачи от угля и 1,48×1014J1,48×1014Дж теплоотдачи в окружающую среду. а) Какую работу совершает электростанция? б) Каков КПД электростанции? (c) В процессе горения происходит следующая химическая реакция: C+O2→CO2C+O2→CO2 . Это означает, что каждые 12 кг угля выбрасывают в атмосферу 12 кг + 16 кг + 16 кг = 44 кг углекислого газа. Предполагая, что 1 кг угля может обеспечить 2,5×106 Дж2,5×106 Дж теплопередачи при сгорании, сколько CO2CO2 выбрасывается в сутки этой электростанцией?
Стратегия для (a)
Мы можем использовать W=Qh-QcW=Qh-Qc, чтобы найти выход работы WW, предполагая, что на электростанции используется циклический процесс. В этом процессе вода кипятится под давлением с образованием высокотемпературного пара, который используется для работы паровых турбин-генераторов, а затем конденсируется обратно в воду, чтобы снова запустить цикл.
В этом процессе вода кипятится под давлением с образованием высокотемпературного пара, который используется для работы паровых турбин-генераторов, а затем конденсируется обратно в воду, чтобы снова запустить цикл.
Решение для (a)
Результат работы определяется как:
W=Qh-Qc.W=Qh-Qc.
15,28
Подставляя данные значения:
W=2,50×1014Дж–1,48×1014Дж=1,02×1014Дж.
15,29
Стратегия для (b)
Эффективность можно рассчитать с помощью Eff=WQhEff=WQh, поскольку QhQh задано, а работа WW была найдена в первой части этого примера.
Решение для (b)
Эффективность определяется как: Eff=WQhEff=WQh. Только что было найдено, что работа WW равна 1,02 × 1014J1,02 × 1014J, и задано QhQh, поэтому эффективность равна
Eff=1,02×1014J2,50×1014J=0,408, или 40,8%Eff=1,02×1014J2,50×1014J=0,408, или 40,8%
15,30
Суточный расход угля
9 рассчитано с использованием информации о том, что каждый день происходит 2,50×1014 Дж2,50×1014 Дж теплопередачи от угля. В процессе горения мы имеем C+O2→CO2C+O2→CO2 . Таким образом, каждые 12 кг угля выбрасывают в атмосферу 12 кг + 16 кг + 16 кг = 44 кг CO2CO2 .
В процессе горения мы имеем C+O2→CO2C+O2→CO2 . Таким образом, каждые 12 кг угля выбрасывают в атмосферу 12 кг + 16 кг + 16 кг = 44 кг CO2CO2 .
Раствор для (с)
Суточный расход угля составляет
2,50×1014J2,50×106Дж/кг=1,0×108кг.2,50×1014J2,50×106Дж/кг=1,0×108кг.
15,31
Предполагая, что уголь чистый и весь уголь идет на производство двуокиси углерода, двуокись углерода, производимая в день, составляет
1,0×108 кг угля×44 кг CO212 кг угля=3,7×108 кг CO2.1,0×108 кг уголь×44 кг CO212 кг уголь=3,7×108 кг CO2.
15.32
Ежедневно производится 370 000 метрических тонн CO2CO2 .
Обсуждение
Если вся выходная мощность преобразуется в электроэнергию в течение одного дня, средняя выходная мощность составит 1180 МВт (это остается вам решить в конце главы). Это значение примерно соответствует размеру крупной обычной электростанции. Найденный КПД приемлемо близок к значению 42%, данному для угольных электростанций. Это означает, что целых 59,2% энергии приходится на передачу тепла в окружающую среду, что обычно приводит к потеплению озер, рек или океана вблизи электростанции, а также к потеплению планеты в целом. Хотя законы термодинамики ограничивают эффективность таких установок, включая установки, работающие на ядерном топливе, нефти и природном газе, передача тепла в окружающую среду может использоваться и иногда используется для обогрева домов или для промышленных процессов. В целом низкая стоимость энергии не делает более экономичным более эффективное использование отработанного тепла от большинства тепловых двигателей. Электростанции, работающие на угле, производят наибольшее количество CO2CO2 на единицу выработки энергии (по сравнению с природным газом или нефтью), что делает уголь наименее эффективным ископаемым топливом.
Найденный КПД приемлемо близок к значению 42%, данному для угольных электростанций. Это означает, что целых 59,2% энергии приходится на передачу тепла в окружающую среду, что обычно приводит к потеплению озер, рек или океана вблизи электростанции, а также к потеплению планеты в целом. Хотя законы термодинамики ограничивают эффективность таких установок, включая установки, работающие на ядерном топливе, нефти и природном газе, передача тепла в окружающую среду может использоваться и иногда используется для обогрева домов или для промышленных процессов. В целом низкая стоимость энергии не делает более экономичным более эффективное использование отработанного тепла от большинства тепловых двигателей. Электростанции, работающие на угле, производят наибольшее количество CO2CO2 на единицу выработки энергии (по сравнению с природным газом или нефтью), что делает уголь наименее эффективным ископаемым топливом.
С информацией, приведенной в примере 15.3, мы можем найти такие характеристики, как КПД тепловой машины, не зная, как она работает, но дальнейшее изучение механизма двигателя даст нам более глубокое понимание. На рис. 15.17 показана работа обычного четырехтактного бензинового двигателя. Четыре показанных шага завершают цикл этой тепловой машины, возвращая смесь бензина и воздуха в исходное состояние.
На рис. 15.17 показана работа обычного четырехтактного бензинового двигателя. Четыре показанных шага завершают цикл этой тепловой машины, возвращая смесь бензина и воздуха в исходное состояние.
Цикл Отто, показанный на рис. 15.18(а), используется в четырехтактных двигателях внутреннего сгорания, хотя на самом деле траектории истинного цикла Отто не соответствуют точно тактам двигателя.
Адиабатический процесс AB соответствует почти адиабатическому такту сжатия бензинового двигателя. В обоих случаях над системой (газовой смесью в цилиндре) совершается работа, повышающая ее температуру и давление. На пути BC цикла Отто теплопередача QhQh в газ происходит при постоянном объеме, вызывая дальнейшее повышение давления и температуры. Этот процесс соответствует сжиганию топлива в двигателе внутреннего сгорания и происходит настолько быстро, что объем почти не меняется. Путь CD в цикле Отто — это адиабатическое расширение, которое действует на внешний мир точно так же, как рабочий ход двигателя внутреннего сгорания действует при его почти адиабатическом расширении.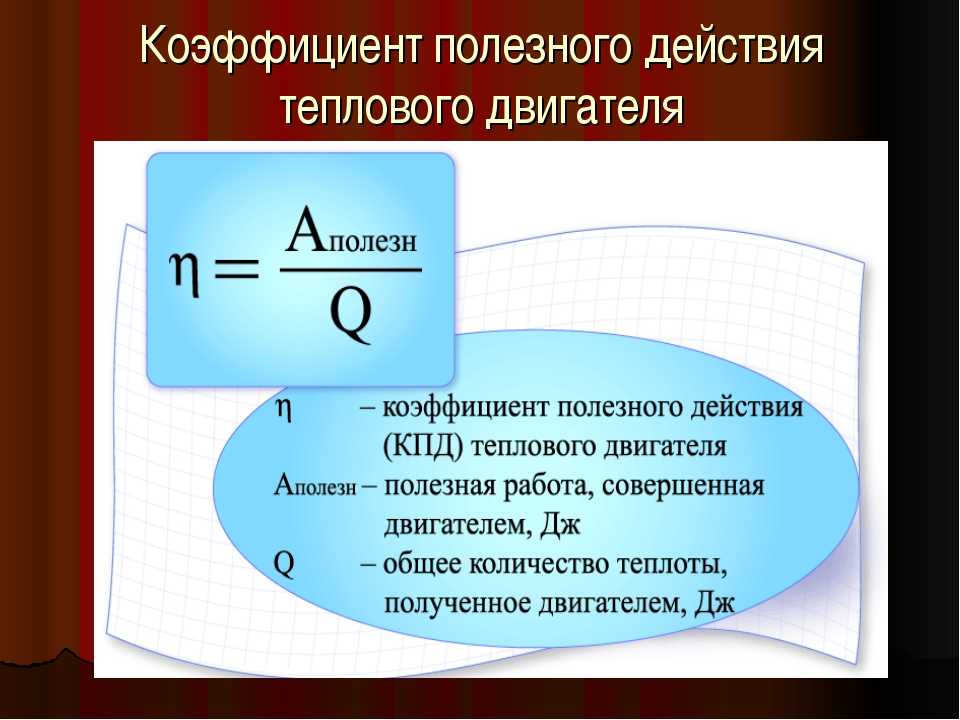 Работа, совершаемая системой на пути CD, больше, чем работа, совершаемая системой на пути AB, потому что давление больше, а значит, есть чистый выход работы. По пути DA в цикле Отто теплоотдача QcQc от газа при постоянном объеме снижает его температуру и давление, возвращая в исходное состояние. В двигателе внутреннего сгорания этот процесс соответствует выпуску горячих газов и впуску воздушно-бензиновой смеси при значительно более низкой температуре. В обоих случаях по этому конечному пути происходит передача тепла в окружающую среду.
Работа, совершаемая системой на пути CD, больше, чем работа, совершаемая системой на пути AB, потому что давление больше, а значит, есть чистый выход работы. По пути DA в цикле Отто теплоотдача QcQc от газа при постоянном объеме снижает его температуру и давление, возвращая в исходное состояние. В двигателе внутреннего сгорания этот процесс соответствует выпуску горячих газов и впуску воздушно-бензиновой смеси при значительно более низкой температуре. В обоих случаях по этому конечному пути происходит передача тепла в окружающую среду.
Чистая работа, выполненная циклическим процессом, представляет собой площадь внутри замкнутого пути на диаграмме PVPV, такой как внутренний путь ABCDA на рис. 15.18. Обратите внимание, что в каждом вообразимом циклическом процессе абсолютно необходима передача тепла от системы, чтобы получить чистую выходную мощность. В цикле Отто передача тепла происходит по пути DA. Если теплопередача не происходит, то обратный путь тот же, а чистая работа равна нулю.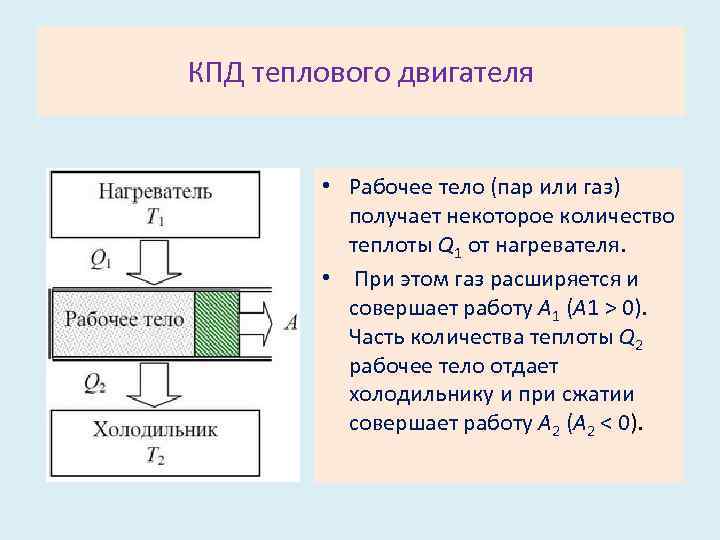 Чем ниже температура на пути АВ, тем меньшую работу необходимо совершить для сжатия газа. Площадь внутри замкнутого пути тогда больше, поэтому двигатель выполняет больше работы и, следовательно, более эффективен. Точно так же, чем выше температура на пути CD, тем больше выходная мощность. (См. рис. 15.19..) Таким образом, эффективность связана с температурами горячего и холодного резервуаров. В следующем разделе мы увидим, каков абсолютный предел эффективности тепловой машины и как он связан с температурой.
Чем ниже температура на пути АВ, тем меньшую работу необходимо совершить для сжатия газа. Площадь внутри замкнутого пути тогда больше, поэтому двигатель выполняет больше работы и, следовательно, более эффективен. Точно так же, чем выше температура на пути CD, тем больше выходная мощность. (См. рис. 15.19..) Таким образом, эффективность связана с температурами горячего и холодного резервуаров. В следующем разделе мы увидим, каков абсолютный предел эффективности тепловой машины и как он связан с температурой.
Рисунок
15.17
В четырехтактном бензиновом двигателе внутреннего сгорания передача тепла в работу происходит в циклическом процессе, показанном здесь. Поршень соединен с вращающимся коленчатым валом, который выполняет работу над газом в цилиндре. а) Воздух смешивается с топливом во время такта впуска. (b) Во время такта сжатия топливовоздушная смесь быстро сжимается в почти адиабатическом процессе, когда поршень поднимается при закрытых клапанах. Работа совершается на газе. (c) Рабочий такт состоит из двух отдельных частей. Во-первых, топливовоздушная смесь воспламеняется, почти мгновенно преобразовывая химическую потенциальную энергию в тепловую, что приводит к значительному увеличению давления. Затем поршень опускается, и газ работает, оказывая силу на расстоянии в почти адиабатическом процессе. (d) Такт выпуска выпускает горячий газ, чтобы подготовить двигатель к следующему циклу, начиная снова с такта впуска.
(c) Рабочий такт состоит из двух отдельных частей. Во-первых, топливовоздушная смесь воспламеняется, почти мгновенно преобразовывая химическую потенциальную энергию в тепловую, что приводит к значительному увеличению давления. Затем поршень опускается, и газ работает, оказывая силу на расстоянии в почти адиабатическом процессе. (d) Такт выпуска выпускает горячий газ, чтобы подготовить двигатель к следующему циклу, начиная снова с такта впуска.
Рисунок
15.18
Диаграмма PVPV для упрощенного цикла Отто, аналогичного используемому в двигателе внутреннего сгорания. Точка А соответствует началу такта сжатия двигателя внутреннего сгорания. Пути AB и CD являются адиабатическими и соответствуют такту сжатия и рабочему такту двигателя внутреннего сгорания соответственно. Траектории BC и DA являются изохорными и приводят к тем же результатам, что и части зажигания и выхлопа-впуска, соответственно, цикла двигателя внутреннего сгорания. Работа совершается газом по пути AB, но больше работы совершается газом по пути CD, так что получается чистая работа.
Рисунок
15.19
Этот цикл Отто производит больший объем работы, чем цикл на рис. 15.18, потому что начальная температура пути CD выше, а начальная температура пути AB ниже. Площадь внутри петли больше, что соответствует большему выходу чистой работы.
Тепловой КПД: определение, пример и двигатель
Изобретение современной паровой машины в 18 веке, несомненно, является одним из самых важных инженерных достижений в истории человечества. Первые паровые двигатели, изобретенные английскими инженерами Томасом Ньюкоменом и Джеймсом Уаттом, значительно ускорили промышленную революцию и сделали Великобританию новым мировым лидером в промышленности. Интересно, однако, что теоретическое понимание того, как работали эти паровые машины, было очень неточным. Не было до 19 й Век, когда была разработана теория тепла и движения, или Термодинамика , когда французский инженер Сади Карно, обеспокоенный промышленным превосходством Великобритании над Францией, попытался улучшить конструкцию паровых машин, рассмотрев общую модель теплоты. двигатели и их термический КПД. Это стремление к промышленной эффективности привело к созданию термодинамики как раздела теоретической физики с невероятно глубокими последствиями для нашего понимания тепла, работы и энергии. В этой статье мы углубимся в то, что такое тепловые двигатели и как мы определяем их эффективность, а затем рассмотрим цикл Карно и то, что он говорит нам о взаимосвязи между теплотой и работой.
двигатели и их термический КПД. Это стремление к промышленной эффективности привело к созданию термодинамики как раздела теоретической физики с невероятно глубокими последствиями для нашего понимания тепла, работы и энергии. В этой статье мы углубимся в то, что такое тепловые двигатели и как мы определяем их эффективность, а затем рассмотрим цикл Карно и то, что он говорит нам о взаимосвязи между теплотой и работой.
Тепловой КПД двигателя
В этой статье мы будем рассматривать термодинамическую модель теплового двигателя, чтобы объяснить концепцию теплового КПД. Итак, прежде чем более подробно рассмотреть тепловую эффективность, давайте вспомним, что именно мы подразумеваем под тепловым двигателем.
A Тепловая машина — это термодинамическая система, преобразующая теплоту в работу.
Общая модель тепловой машины представляет собой систему, обычно состоящую из газа, находящегося между двумя тепловыми резервуарами, один из которых имеет более высокую температуру, чем система, а другой — более низкую температуру. В контексте тепловой машины мы называем эти резервуары источником тепла и поглотителем соответственно. Система способна совершать работу, обозначаемую \(W\) в окружающей среде, например, толкая поршень вверх по мере расширения газа. Именно эта работа \(W\) делает двигатель полезным, например, в автомобильном двигателе эта работа используется для поворота оси, заставляющей вращаться колеса. Из-за разницы температур тепло передается от источника тепла к системе. Это обозначено \(Q_\mathrm{H}\) на рисунке 1. Часть этого тепла будет использована для совершения полезной работы в окружающей среде, в то время как часть тепла увеличит внутреннюю энергию газа, повысив его температуру. Затем разница температур между системой и радиатором вызовет поток тепла от системы к радиатору, при этом эта энергия обозначается \(Q_\mathrm{C}\).
В контексте тепловой машины мы называем эти резервуары источником тепла и поглотителем соответственно. Система способна совершать работу, обозначаемую \(W\) в окружающей среде, например, толкая поршень вверх по мере расширения газа. Именно эта работа \(W\) делает двигатель полезным, например, в автомобильном двигателе эта работа используется для поворота оси, заставляющей вращаться колеса. Из-за разницы температур тепло передается от источника тепла к системе. Это обозначено \(Q_\mathrm{H}\) на рисунке 1. Часть этого тепла будет использована для совершения полезной работы в окружающей среде, в то время как часть тепла увеличит внутреннюю энергию газа, повысив его температуру. Затем разница температур между системой и радиатором вызовет поток тепла от системы к радиатору, при этом эта энергия обозначается \(Q_\mathrm{C}\).
Рис. 1. Обобщенная модель тепловой машины, как показано выше, позволяет определить тепловой КПД, не беспокоясь о точной природе потерь энергии.
Тепловой КПД Определение
Тепловые двигатели работают путем преобразования энергии, переданной в виде тепла, в полезную работу. Однако, как мы увидим, ни одна тепловая машина не является абсолютно эффективной, поэтому некоторое количество тепла всегда теряется в окружающую среду. Мы можем определить эту потерю тепла как отработанное тепло: чем меньше тепла теряется, тем эффективнее работает двигатель. Итак, КПД двигателя определяется количеством полезной работы, совершаемой на единицу подведенного тепла. Затем можно использовать термический КПД для количественной оценки этого КПД.
Однако, как мы увидим, ни одна тепловая машина не является абсолютно эффективной, поэтому некоторое количество тепла всегда теряется в окружающую среду. Мы можем определить эту потерю тепла как отработанное тепло: чем меньше тепла теряется, тем эффективнее работает двигатель. Итак, КПД двигателя определяется количеством полезной работы, совершаемой на единицу подведенного тепла. Затем можно использовать термический КПД для количественной оценки этого КПД.
Тепловой КПД \(\eta\), или Коэффициент полезного действия, — это процент подводимого тепла \(Q\), поступающего в систему, который преобразуется системой в работу \(Вт\).
\[\eta=\frac{W}{Q}.\]
Тепловой КПД может принимать значения только между \(0\) и \(1\), \(0\%-100\%\) , в чем можно убедиться, применив первый закон термодинамики к определению \(\эта\). Рассмотрим тепловложение двигателя \(Q_\text{in}\). Предполагая, что в самом двигателе энергия не теряется, любое тепло, не преобразованное в работу, будет потеряно в виде тепла \(Q_\text{out}\) в окружающую среду. Следовательно, мы можем определить проделанную работу как \[W=Q_\text{in}-Q_\text{out}.\]
Следовательно, мы можем определить проделанную работу как \[W=Q_\text{in}-Q_\text{out}.\]
Подключив это к определению теплового КПД, мы получим
\[\begin{align}\eta&=\frac{W}{Q_\text{in}}\\&=\frac{Q_\text{in} -Q_\text{out}}{Q_\text{in}}\\&=1-\frac{Q_\text{out}}{Q_\text{in}}.\end{align}\]
Тепловой КПД может принимать значения только между \(0\) и \(1\), \(0\%-100\%\), как можно увидеть, применив первый закон термодинамики к определению для \(\eta \). Рассмотрим тепловложение двигателя \(Q_\text{in}\). Предполагая, что в самом двигателе энергия не теряется, любое тепло, не преобразованное в работу, будет потеряно в виде тепла \(Q_\text{out}\) в окружающую среду. Следовательно, мы можем определить проделанную работу как \[W=Q_\text{in}-Q_\text{out}.\]
Подключив это к определению теплового КПД, мы получим
\[\begin{align}\eta&=\frac{W}{Q_\text{in}}\\&=\frac{Q_\text{in} -Q_\text{out}}{Q_\text{in}}\\&=1-\frac{Q_\text{out}}{Q_\text{in}}.\end{align}\]
Первый закон термодинамики гарантирует, что тепло, теряемое системой, не может быть больше, чем тепло, поступающее в систему, и поэтому \(0\leq\eta\leq1\).
Первый закон термодинамики гласит, что изменение внутренней энергии системы \(\Delta U\) всегда должно быть равно разнице между теплом, подведенным к системе \(Q\), и работой выполняется системой в ее среде \(W\).
\[\Delta U=Q-W.\]
Давайте рассмотрим пример.
Если тепловой двигатель, который работает, поглощая \(500\,\mathrm{Дж}\) тепла, теряет \(200\,\mathrm{Дж}\) тепла в окружающую среду во время своего цикла, что такое тепловой КПД этого двигателя?
Ответ:
Используя приведенную выше формулу:\[\begin{align}\nu&=1-\frac{Q_\text{out}}{Q_\text{in}}\\&=1-\frac {200\,\mathrm{J}}{500\,\mathrm{J}}\\&=0,6 \quad \text{или}\quad 60\%.\end{align}\]
Как вы знаете, если вы когда-нибудь видели перегрев двигателя автомобиля, большинство тепловых двигателей крайне неэффективны. Например, средний дизельный двигатель работает с КПД около \(25\%\), а даже самый эффективный из тепловых двигателей может достигать только \(50\%-60\%\). Большая часть этой неэффективности связана с потерями тепла и силами трения внутри двигателя, а также с потерями в процессе сгорания. Однако, как мы увидим при исследовании цикла Карно, совершенная эффективность невозможна даже для идеализированных Реверсивные двигатели в соответствии с 2 и Законом термодинамики.
Большая часть этой неэффективности связана с потерями тепла и силами трения внутри двигателя, а также с потерями в процессе сгорания. Однако, как мы увидим при исследовании цикла Карно, совершенная эффективность невозможна даже для идеализированных Реверсивные двигатели в соответствии с 2 и Законом термодинамики.
Пример теплового КПД
Многие бытовые приборы и технологии, необходимые в современном обществе, основаны на этой простой модели теплового двигателя, и повышение эффективности этих приборов может помочь сократить потребление энергии. Например, при покупке холодильника перед покупкой важно сравнить коэффициент полезного действия (КПД) разных моделей. Холодильник представляет собой своего рода тепловую машину в обратном направлении, в которой работа, выполняемая окружающей средой в системе, обычно в виде компрессора, для извлечения тепла из холодного резервуара (внутри холодильника) и откачки его в горячий резервуар (наружная комната).
Рис. 2. Холодильник можно представить как тепловую машину, работающую в обратном направлении, извлекающую тепло из холодного резервуара и перекачивающую его в горячий резервуар, совершая работу.
Это означает, что для холодильников КПД определяется обратно пропорционально тепловому КПД тепловой машины, так как в данном случае нас интересует, сколько тепла может быть извлечено за единицу работы. Здесь «отработанное» тепло — это тепло, переданное в систему окружающей средой \(Q_\text{in}\).
\[\begin{align}COP &= \frac{Q_\text{out}}{W_\text{in}} \\&=\frac{Q_\text{out}}{Q_\text{in }-Q_\text{out} }\\&=\frac{Q_\text{out}}{Q_\text{in}}-1\end{align}\]
Это означает, что, в отличие от теплового КПД, КПД может принимать значения больше единицы, чем выше КПД, тем больше тепла отводится за единицу работы.
Среднестатистический современный холодильник работает с КПД \(1,37.\) Если мощность холодильника составляет \(300\,\mathrm{Вт}\), сколько тепла извлекается из внутренней части холодильника за одна минута?
Ответ:
Сначала нам нужно рассчитать, какую работу совершает холодильник за одну минуту, это можно найти из определения мощности. \[\begin{align}\text{Power}&=\frac {\text {Выполненная работа}}{\text {Время}}\\ подразумевает \text{Выполненная работа}=\text{Мощность}\cdot\text{Время}\\\ подразумевает W&=300\,\mathrm{W }\cdot60\,\mathrm{s}\\&=18000\,\mathrm{J}\end{align}\]
\[\begin{align}\text{Power}&=\frac {\text {Выполненная работа}}{\text {Время}}\\ подразумевает \text{Выполненная работа}=\text{Мощность}\cdot\text{Время}\\\ подразумевает W&=300\,\mathrm{W }\cdot60\,\mathrm{s}\\&=18000\,\mathrm{J}\end{align}\]
Комбинируя это с определением COP, мы получаем отведенное тепло\[\begin{align}Q_\text{out}&=COP\cdot W\\&=1,37\cdot18\,000\,\mathrm{J} \\&=24\,660\,\mathrm{J}\end{align}\]
Тепловой КПД цикла Карно
Мы коснулись идеи, что даже для идеализированной обратимой тепловой машины \( 100\%\) КПД невозможен. Впервые это понял французский физик и инженер Сади Карно, который установил верхний предел теплового КПД тепловой машины, рассмотрев идеальный термодинамический процесс, теперь известный как цикл Карно.
Рис. 3. Сади Карно (1796-1832) получил прозвище «Отец термодинамики» благодаря своей работе над тепловыми двигателями и тепловым КПД.
Цикл Карно является наиболее эффективной тепловой машиной, потому что это обратимый процесс. В обратимом процессе энергия не теряется в окружающую среду или из-за диссипативных сил, таких как трение. Определяющей чертой обратимого процесса является отсутствие изменения чистой энтропии в системе в конце процесса.
В обратимом процессе энергия не теряется в окружающую среду или из-за диссипативных сил, таких как трение. Определяющей чертой обратимого процесса является отсутствие изменения чистой энтропии в системе в конце процесса.
А обратимый термодинамический процесс — это процесс, который переводит систему из некоторого начального состояния через цикл различных термодинамических состояний, прежде чем вернуть ее обратно в точное начальное состояние.
Обратимых процессов в природе не наблюдается, так как практически невозможно предотвратить возникновение сил трения как между самими молекулами жидкости, так и внутри компонентов системы, таких как поршень в тепловом двигателе. Таким образом, цикл Карно не является работающей тепловой машиной, однако он предлагает простую иллюстрацию взаимосвязи между такими величинами, как теплота, работа и температура в тепловых машинах. Давайте теперь посмотрим на особенности цикла Карно.
Цикл Карно
Цикл Карно рассматривает тепловую машину, описанную в начале этой статьи, в которой идеальный газ удерживается между двумя тепловыми резервуарами, один при \(T_\mathrm{H}\), а другой при \( T_\mathrm{C}\), с \(T_\mathrm{H}>T_\mathrm{C}\). Работа может совершаться газом над окружающей средой (или наоборот) с помощью подвижного поршня. Цикл состоит из четырех различных термодинамических процессов: изотермического расширения, изэнтропического расширения, изотермического сжатия и изэнтропического сжатия. Этот список довольно громоздкий, поэтому давайте рассмотрим некоторые определения. Во-первых, сжатие и расширение относятся к влиянию процесса на объем газа.
Работа может совершаться газом над окружающей средой (или наоборот) с помощью подвижного поршня. Цикл состоит из четырех различных термодинамических процессов: изотермического расширения, изэнтропического расширения, изотермического сжатия и изэнтропического сжатия. Этот список довольно громоздкий, поэтому давайте рассмотрим некоторые определения. Во-первых, сжатие и расширение относятся к влиянию процесса на объем газа.
Сжатие — Процесс уменьшения объема газа за счет того, что среда совершает над ним работу. В случае с тепловым двигателем эта работа выполняется за счет перемещения поршня вниз.
Расширение — Процесс увеличения объема газа за счет того, что он совершает работу над окружающей средой. В тепловом двигателе газ расширяется, толкая поршень вверх.
В то время как изотермические и изоэнтропические относятся к условиям, при которых происходит процесс, и какое количество остается постоянным на всем протяжении.
Изотермический — Термодинамический процесс, во время которого в системе поддерживается постоянная температура.
Изэнтропический — Это обратимый адиабатический процесс, означающий, что нет чистого изменения энтропии в конце процесса (обратимый) и что между системой и окружающей средой не происходит теплообмена на протяжении всего процесса (адиабатический).
Имея в виду эти определения, давайте пройдемся по четырем стадиям цикла Карно.
Изотермическое расширение: Изначально идеальный газ находится в тепловом контакте с горячим резервуаром, будучи теплоизолированным от холодного резервуара. Температура газа бесконечно меньше, чем в горячем резервуаре, что позволяет передавать тепло без какого-либо изменения температуры газа. Эта передача тепла \(Q_\mathrm{H}\) заставляет газ расширяться, при этом вся тепловая энергия расходуется на работу, толкающую поршень вверх, поэтому температура не меняется. Согласно закону идеального газа, при расширении газа при постоянной температуре происходит соответствующее падение давления. Теплоперенос соответствует увеличению энтропии газа.

\[\Delta S_\mathrm{H}=\frac{Q_\mathrm{H}}{T_\mathrm{H}}.\]
Изэнтропическое расширение: Затем газ термически изолирован от оба резервуара, поэтому передача тепла не может происходить. Однако расширение продолжается из-за увеличения давления, заставляющего газ совершать работу над поршнем. Эта работа, совершаемая газом, вызывает уменьшение его внутренней энергии, поэтому газ охлаждается до температуры бесконечно малой, превышающей \(T_\mathrm{C}\). Поскольку нет теплопередачи, энтропия не меняется.
Изотермическое сжатие: Теперь газ термически изолирован от горячего резервуара, но находится в тепловом контакте с холодным резервуаром. Поршень работает над газом, сжимающим его, при этом вся эта работа преобразуется в отработанное тепло \(Q_\mathrm{C}\), теряемое в холодном резервуаре, поэтому температура не меняется. Сжатие при постоянной температуре вызывает увеличение давления. Существует уменьшение энтропии газа, определяемое выражением \(\Delta S_\mathrm{C}=\frac{Q_\mathrm{C}}{T_\mathrm{C}}\).

Изэнтропическое сжатие: Газ снова термически изолирован от обоих резервуаров, при этом окружающая среда продолжает выполнять над ним работу. Эта работа, совершаемая над газом, увеличивает внутреннюю энергию газа, повышая температуру до бесконечно малого значения, меньшего, чем \(T_\mathrm{H}\), и возвращая систему в исходное состояние. В этой точке энтропия не меняется, так как нет теплопередачи.
Цикл Карно часто представляют в виде замкнутой траектории вокруг графика давление-объем, как показано на рис. 3. Кривая AB следует траектории при фиксированной температуре, известной как изотерма , представляющая начальное изотермическое сжатие. BC представляет собой адиабатическое сжатие, наблюдаемое по тому факту, что на этом пути отсутствует теплообмен. Затем цикл завершается кривой CD, следующей за изотермой более низкой температуры, прежде чем DA возвращает систему в исходное состояние. Обратите внимание, что работа, выполненная системой, определяется площадью, ограниченной кривой.
Рис. 3. Цикл Карно можно представить в виде замкнутой кривой на графике давление-объем, как показано выше. Шаг 1 следует по кривой AB, шаг 2 следует по кривой BC, шаг 3 следует по CD, а шаг 4 следует по DA.
Итак, что этот цикл может рассказать нам о тепловом КПД тепловой машины? Что ж, давайте сначала посмотрим, как меняется энтропия системы на протяжении всего процесса. Как обратимый процесс, в цикле Карно не может быть никакого изменения чистой энтропии. Отсюда \[\Delta S_\mathrm{H}+\Delta S_\mathrm{C}=\Delta_{\text{net}}=0\]
Применяя определение энтропии, \(\Delta S=\frac {Q}{T}\), мы находим связь между теплотой, передаваемой между системой и тепловыми резервуарами, и температурой этих тепловых резервуаров.\[\begin{align}\frac{Q_\mathrm{H}} {T_\mathrm{H}}+\frac{Q_\mathrm{C}}{T_\mathrm{C}}&=0\\\ подразумевает \frac{Q_\mathrm{H}}{T_\mathrm{H }}&=-\frac{Q_\mathrm{C}}{T_\mathrm{C}}\\\ подразумевает \frac{Q_\mathrm{C}}{Q_\mathrm{H}}&=-\frac {T_\mathrm{C}}{T_\mathrm{H}}\end{align}\]
Применение этого к определению эффективности дает \[\eta=1+\frac{Q_\mathrm{C}}{Q_\mathrm{H}}=1-\frac{T_\mathrm{C}}{T_ \mathrm{H}}. \]
\]
Это основное свойство обратимых тепловых двигателей, их эффективность определяется только температурами резервуаров, между которыми они работают. Чем больше соотношение между \(T_\mathrm{H}\) и \(T_\mathrm{C}\), при \(T_\mathrm{C}термодинамике. \mathrm{h}\)>
Если обратимая тепловая машина работает между двумя тепловыми резервуарами, один при \(T_1=300\,\mathrm{K}\) и один при \(T_2=400\,\mathrm{K}\), каков его тепловой КПД?
Ответ:
Используя приведенное выше уравнение, мы находим эффективность как \[\begin{align}\eta&=1-\frac{T_1}{T_2}\\&=1-\frac{300\,\ mathrm{K}}{400\,\mathrm{K}} \\&=25\%.\end{align}\]
2
nd Закон тепловой эффективности
Сэди Карно поняла, что из-за отсутствия любой потери энергии в обратимом двигателе, КПД обратимого теплового двигателя является максимально возможным КПД любого теплового двигателя. Это было резюмировано в его весьма влиятельной теореме.
Теорема Карно утверждает, что тепловая машина, работающая между двумя тепловыми резервуарами \(T_\mathrm{H},T_\mathrm{C}\), не может иметь КПД больше, чем у обратимой тепловой машины (тепло Карно двигатель), работающий между одними и теми же двумя температурами.
Как мы видели, эффективность обратимой тепловой машины определяется только температурами тепловых резервуаров, между которыми она работает.
\[\eta=1-\frac{T_\mathrm{C}}{T_\mathrm{H}}.\]
Это уравнение говорит нам, что единственный способ для \(\eta\) равняться единице, если \(T_\mathrm{C}=0\,\mathrm{K}\), известный как абсолютный ноль. Однако третий закон термодинамики запрещает любой системе когда-либо достигать абсолютного нуля, поэтому мы видим, что наша обратимая тепловая машина не может иметь идеальный КПД.
Третий закон термодинамики гласит, что термодинамическая система не может достичь абсолютного нуля за конечное число шагов
Итак, если двигатель Карно не может иметь КПД, равный единице, по третьему закону , и никакой тепловой двигатель не может иметь больший КПД, чем двигатель Карно, по теореме Карно, то все двигатели должны иметь тепловой КПД меньше единицы.\[\begin{align}\eta&<1\\\frac{W} {Q_\text{in}}&<1\\W&
Это показывает, что тепловая энергия никогда не может быть полностью преобразована в работу во время циклического процесса, такого как тепловой двигатель. Этот факт известен как заявление Кельвина о втором законе термодинамики.
Заявление Кельвина о 2 nd Закон термодинамики: Невозможно полностью преобразовать тепло во время циклического процесса.
Тепловой КПД – основные выводы
- Тепловая машина – это термодинамическая система, преобразующая переданную ей энергию в виде тепла в полезную работу. Распространенной моделью тепловой машины является газ, находящийся в тепловом контакте с двумя резервуарами, один из которых имеет более высокую температуру, чем газ \(T_\mathrm{H}\), а другой — более низкую температуру \(T_\mathrm{C}\). ).
- Тепловой КПД тепловой машины – это отношение работы, выполненной системой, к подведенной системе теплоте\[\eta=\frac{W}{Q}.\]
- Тепловой КПД тепловой машины двигатель можно представить в терминах подводимой теплоты из горячего резервуара \(Q_\mathrm{H}\) и отходящего тепла, теряемого в холодный резервуар \(Q_\mathrm{C}\)\[\eta=\frac{ Q_\mathrm{H}-Q_\mathrm{C}}{Q_\mathrm{H}}=1-\frac{Q_\mathrm{C}}{Q_\mathrm{H}}.