Аберрантное метилирование промоторных областей генов SOX7, p15INK4b и антагонистов сигнального пути Wnt у больных острыми миелоидными лейкозами
АМ — аберрантное метилирование
ДИ — доверительный интервал
ОВ — общая выживаемость
ОМЛ — острый миелоидный лейкоз
ОШ — отношение шансов
Аберрантное метилирование (АМ) промоторных областей некоторых генов, участвующих в регуляции процессов дифференцировки и пролиферации клеток, рассматривается как один из принципиальных механизмов патогенеза ряда гемобластозов, включая острый миелоидный лейкоз (ОМЛ) [1, 2]. В отличие от генетических аберраций, нередко обнаруживаемых при лейкозной трансформации, эффект АМ реализуется на эпигенетическом уровне, поскольку в данном случае не происходит изменения последовательности нуклеотидов в молекуле ДНК [3]. Избыточное метилирование остатков цитозина в регуляторной области гена, происходящее главным образом в островках CpG, приводит к снижению или полной блокировке его транскрипционной активности. Несмотря на то что данный механизм является важнейшим регулятором генной экспрессии в онтогенезе, нарушение процессов метилирования в клетке может стать одной из причин ее злокачественной трансформации.
Несмотря на то что данный механизм является важнейшим регулятором генной экспрессии в онтогенезе, нарушение процессов метилирования в клетке может стать одной из причин ее злокачественной трансформации.
Предполагается, что роль гиперметилирования ДНК в лейкозогенезе опосредована инактивацией определенных генов — супрессоров опухолевого роста. Вместе с тем недостаточно информации о том, какие именно гены-супрессоры характеризуются АМ при том или ином варианте лейкоза. При ОМЛ в качестве потенциальных кандидатов рассматриваются гены SOX7, p15INK4b и антагонисты сигнального пути Wnt/β-катенина, включая гены семейства SFRP (secreted frizzled related proteins) [4—9]. Известно, что метилирование генов SFRP приводит к увеличению уровня цитоплазматического и внутриядерного β-катенина, повышению экспрессии генов c-MYC и циклина D1 (CCND1), дизрегуляции клеточного цикла [4, 5].
Изучение процессов метилирования у онкогематологических больных представляет практический интерес. Это связано с опубликованными данными о возможной ассоциации статуса АМ с неблагоприятным течением миелоидных неоплазий, а также внедрением в клиническую практику гипометилирующих препаратов, в частности децитабина и 5-азацитидина (азануклеозиды) [1, 2]. Результаты исследований статуса метилирования генов семейства SFRP при ОМЛ носят противоречивый характер, что отражает гетерогенность биологического фенотипа заболевания и не исключает влияние половой и расовой принадлежности больных [5—9]. Более привлекательным для практического использования представляется совокупный анализ статуса метилирования генов SFRP с другими генами, например, SOX7 и p15INK4b [10]. В этом случае возможно получение новых данных, в частности об ассоциации числа аберрантных генов с клинико-гематологическими показателями и прогнозом заболевания [11]. Выделение однородных групп больных со значительным числом метилированных генов может послужить основанием для модификации лечебного пособия, что имеет принципиальное значение для пациентов, которым по разным причинам не может быть назначена интенсивная полихимиотерапия, а монотерапия азануклеозидами не дает желаемого результата [12, 13].
Это связано с опубликованными данными о возможной ассоциации статуса АМ с неблагоприятным течением миелоидных неоплазий, а также внедрением в клиническую практику гипометилирующих препаратов, в частности децитабина и 5-азацитидина (азануклеозиды) [1, 2]. Результаты исследований статуса метилирования генов семейства SFRP при ОМЛ носят противоречивый характер, что отражает гетерогенность биологического фенотипа заболевания и не исключает влияние половой и расовой принадлежности больных [5—9]. Более привлекательным для практического использования представляется совокупный анализ статуса метилирования генов SFRP с другими генами, например, SOX7 и p15INK4b [10]. В этом случае возможно получение новых данных, в частности об ассоциации числа аберрантных генов с клинико-гематологическими показателями и прогнозом заболевания [11]. Выделение однородных групп больных со значительным числом метилированных генов может послужить основанием для модификации лечебного пособия, что имеет принципиальное значение для пациентов, которым по разным причинам не может быть назначена интенсивная полихимиотерапия, а монотерапия азануклеозидами не дает желаемого результата [12, 13].
Цель исследования — изучить статус метилирования генов SOX7, p15INK4b и антагонистов сигнального пути Wnt у больных ОМЛ для оценки сопряженности частоты АМ с морфологическим вариантом и характером хромосомных аберраций, а также влияние статуса метилирования на выживаемость больных.
Материалы и методы
Для достижения поставленной цели из банка биологических образцов отобрали образцы геномной ДНК 57 больных ОМЛ, соответствующих следующим условиям: наличие подписанного информированного согласия на обследование и лечение, достаточное для исследования количество ДНК, отсутствие в анамнезе указаний на ранее проводимую терапию гипометилирующими препаратами, доступность клинико-гематологических показателей и информации о результатах терапии. Больных острым промиелоцитарным лейкозом в исследование не включали.
Возраст больных, из которых 20 мужчин и 37 женщин, был в диапазоне от 20 до 79 лет, медиана 51 год. Диагноз устанавливали по критериям классификации ВОЗ. Верификацию отдельных вариантов осуществляли по результатам изучения морфологических препаратов костного мозга, цитохимического анализа и иммунофенотипирования бластных клеток. Распределение по вариантам было следующим: 2 больных с вариантом М0, 7 — с М1, 23 — с М2, 4 — с М4, 8 — с М5, 3 — с М6 и 10 — с ОМЛ с миелодисплазией. У 8 больных ОМЛ с миелодисплазией в анамнезе имелись указание на один из вариантов миелодиспластического синдрома.
Верификацию отдельных вариантов осуществляли по результатам изучения морфологических препаратов костного мозга, цитохимического анализа и иммунофенотипирования бластных клеток. Распределение по вариантам было следующим: 2 больных с вариантом М0, 7 — с М1, 23 — с М2, 4 — с М4, 8 — с М5, 3 — с М6 и 10 — с ОМЛ с миелодисплазией. У 8 больных ОМЛ с миелодисплазией в анамнезе имелись указание на один из вариантов миелодиспластического синдрома.
По результатам изучения кариотипа, известного у 56 больных, сформировали 3 группы: 31 (54,4%) больной с нормальным кариотипом, 8 (14,0%) с комплексным кариотипом и 17 (29,8%) с другими хромосомными аберрациями.
Заготовку образцов крови для исследования статуса метилирования осуществляли при диагностике ОМЛ. Геномную ДНК выделяли стандартным способом. До проведения исследования образцы ДНК хранили при температуре –20 °С. Статус метилирования генов изучали посредством метилспецифической полимеразной цепной реакции [14—16].
Статистическую обработку данных осуществляли по точному методу Фишера. Для описания межгрупповых различий использовали отношение шансов (ОШ) с 95% доверительным интервалом (ДИ) и значением р. Кривые Каплана—Майера использовали для расчета выживаемости.
Для описания межгрупповых различий использовали отношение шансов (ОШ) с 95% доверительным интервалом (ДИ) и значением р. Кривые Каплана—Майера использовали для расчета выживаемости.
Результаты
Признаки АМ ≥1 генов выявлены у 52 (91,2%) из 57 больных. У 5 пациентов статус метилирования исследованных генов не был изменен. На рис. 1 представлены данные о доле больных с аберрантным статусом метилирования отдельных генов. Наиболее часто выявлялось метилирование генов SFRP1 и p15INK4b — у 39 (68,4%) и 36 (63,2%) больных соответственно. Следующими по частоте убывания оказались гены SOX7, SFRP4 и SFRP5 — у 27 (47,4%), 24 (42,1%) и 20 (35,1%) больных соответственно. Метилирование ≥1 гена семейства SFRP обнаружено у 48 (84,2%) больных.
Рис. 1. Частота А.М. исследованных генов у больных ОМЛ.
При анализе распределения больных по числу метилированных генов установлено, что метилирование 1, 2, 3, 4 и 5 генов имелось у 8 (14,0%), 17 (29,8%), 12 (21,1%), 7 (12,3%) и 8 (14%) больных соответственно. Таким образом, наиболее частой находкой было АМ двух или трех генов одновременно. Статистически значимого различия в распределении по числу генов с АМ между больными в возрасте моложе или старше 60 лет не обнаружено.
Таким образом, наиболее частой находкой было АМ двух или трех генов одновременно. Статистически значимого различия в распределении по числу генов с АМ между больными в возрасте моложе или старше 60 лет не обнаружено.
Учитывая небольшое число больных с отдельными вариантами ОМЛ, мы посчитали нецелесообразным сравнивать характер распределения по числу генов с АМ в группах, выделенных по морфологическим критериям. Вместе с тем необходимо отметить следующие находки. Во-первых, половина всех случаев с метилированием 5 генов (4 из 8 больных) приходилась на группу ОМЛ с миелодисплазией. Во-вторых, среди больных ОМЛ с миелодисплазией было больше лиц с одновременным метилированием 3—5 генов — 7 (70%) из 10, чем при любом другом варианте.
В группах, сформированных по результатам цитогенетического исследования, выявлено, что у больных с нормальным кариотипом чаще обнаруживалось метилирование генов SFRP1 и p15INK4b: в 71 и 64,5% случаев соответственно. Аберрантный статус метилирования этих же генов, а также гена SOX7 были наиболее частой находкой у больных с хромосомными поломками независимо от их вида: 64, 60 и 64% соответственно.
При анализе числа метилированных генов в группах с разными вариантами кариотипа выявлено, что у больных с нормальным кариотипом или с одной или двумя независимыми хромосомными аберрациями чаще обнаруживалось метилирование 2 (32,3 и 29,4% соответственно) и 3 (22,6 и 23,5% соответственно) генов одновременно. Напротив, метилирование 5 генов чаще выявлялось у больных с множественными хромосомными аберрациями (рис. 2). Отражением этого является статистически значимое различие между долей больных с комплексным и нормальным кариотипом, у которых выявлено одновременное метилирование 5 генов: 50% против 9,7% соответственно (ОШ 9,3 при 95% ДИ от 1,5 до 58,0; p=0,022). Еще более выраженное различие по данному показателю наблюдалось при сравнении группы больных с комплексным кариотипом со всеми остальными пациентами (50% против 8,3% соответственно; ОШ 11,0 при 95% ДИ от 2,0 до 61,6; p=0,01).
Рис. 2. Число генов с аберрантным статусом метилирования при различных вариантах кариотипа. Цвет соответствует числу аберрантных генов.
Цвет соответствует числу аберрантных генов.
В ходе исследования также изучено влияние числа генов с аберрантным статусом метилирования (0—2 против 3—5) на выживаемость больных с нормальным кариотипом при проведении стандартной индукционной терапии. Для этого из анализа исключены данные 5 больных, у которых выявлены мутации генов FLT3 и NPM1, и 3 больных, которые по причине возраста, наличия сочетанных заболеваний и соматического статуса не получали такой терапии. Из оставшихся больных у 13 метилированы от 0 до 2 генов и у 10 больных — от 3 до 5 генов.
В группе с 0—2 метилированными генами полная ремиссия достигнута у 9 (69,2%) больных. У 4 больных констатирован первично-резистентный вариант, рецидив ОМЛ развился у 5. Медиана времени наблюдения составила 24 (7—64) мес. В группе с 3—5 метилированными генами полная ремиссия диагностирована у 8 (80%) больных, из которых у 4 в последующем развился рецидив. Период наблюдения варьировал от 2 до 96 мес, медиана 17 мес. Как отражено на рис. 3, медиана общей продолжительности жизни между группами не различалась: не достигнута и 31 мес соответственно. Кроме того, не различалась и медиана продолжительности жизни без рецидивов: 26,7 и 33,5 мес в группах с 0—2 и 3—5 метилированными генами соответственно.
Как отражено на рис. 3, медиана общей продолжительности жизни между группами не различалась: не достигнута и 31 мес соответственно. Кроме того, не различалась и медиана продолжительности жизни без рецидивов: 26,7 и 33,5 мес в группах с 0—2 и 3—5 метилированными генами соответственно.
Рис. 3. Зависимость кривой выживаемости от числа генов с АМ. Ме — медиана.
Обсуждение
Результаты проведенного исследования в сочетании с данными литературы дают основание рассматривать АМ генов как неслучайный биологический феномен, наблюдающийся у большинства больных ОМЛ. Ранее рядом авторов получены различные данные относительно частоты метилирования отдельных генов у больных ОМЛ, что, вероятно, объясняется сопряженностью аберрантного статуса с вариантом и стадией заболевания, а также характером молекулярных и цитогенетических аберраций. Так, Н. Kroeger и соавт. [17] при обследовании 30 больных во время постановки диагноза ОМЛ наибольшую частоту аберрантного статуса выявили в генах CDh23 (83%), OLIG2 (77%), PGRA (72%), PGRB (70%), NOR1 (63%), NPM2 (63%) и p15 (47%). При рецидиве число больных с метилированными генами CDh23, PGRA и p15 увеличивалось до 93, 92 и 80% соответственно. H. Hou и соавт. [8] обнаружили статистически значимое различие по частоте метилирования антагонистов сигнального пути Wnt между больными М0- и М4/М5-вариантами ОМЛ de novo: 100% против 47,3% (р=0,0006). E. Jost и соавт. [5] установили ассоциацию между гиперметилированием одного и более генов семейства SFRP с вариантами CBF ОМЛ (р=0,02).
При рецидиве число больных с метилированными генами CDh23, PGRA и p15 увеличивалось до 93, 92 и 80% соответственно. H. Hou и соавт. [8] обнаружили статистически значимое различие по частоте метилирования антагонистов сигнального пути Wnt между больными М0- и М4/М5-вариантами ОМЛ de novo: 100% против 47,3% (р=0,0006). E. Jost и соавт. [5] установили ассоциацию между гиперметилированием одного и более генов семейства SFRP с вариантами CBF ОМЛ (р=0,02).
Внимание, уделяемое исследователями гену p15INK4b, объясняется его ролью в процессах регуляции клеточного цикла. Метилирование островков CpG промоторных областей p15INK4b сопровождается подавлением активности гена с последующим снижением чувствительности лейкозных клеток к ингибирующему действию β-фактора, трансформирующего рост (TGFβ) [18]. АМ p15INK4b — типичное для больных вторичными ОМЛ и миелодиспластическим синдромом эпигенетическое событие, ассоциированное с аберрациями 7-й хромосомы и неблагоприятным прогнозом [19]. Прогностическая значимость аберрантного статуса гена p15INK4b у больных ОМЛ de novo сомнительна [20, 21]. В то же время M. Grovdal и соавт. [22] констатировали отсутствие полной ремиссии после стандартного индукционного курса у больных с миелодными неоплазиями в случае гиперметилирования гена p15INK4b одновременно с генами CDH и HIC.
Прогностическая значимость аберрантного статуса гена p15INK4b у больных ОМЛ de novo сомнительна [20, 21]. В то же время M. Grovdal и соавт. [22] констатировали отсутствие полной ремиссии после стандартного индукционного курса у больных с миелодными неоплазиями в случае гиперметилирования гена p15INK4b одновременно с генами CDH и HIC.
Участие сигнального пути Wnt/β-катенина в гемопоэзе обусловливает повышенный интерес к механизмам его регуляции и, в частности, к таким ингибиторам, как DKK1 и 2, LKB1, RASS-F1A, RUNX3, SFRPs, SOX17 и WIF1 [7, 23]. Метилирование островков CpG промоторных областей генов, контролирующих ингибиторы Wnt, — частая находка у больных ОМЛ. А. Valencia и соавт. [6] у 64% обследованных больных обнаружили АМ, по крайней мере, 1 из 6 изученных генов. Метилирование генов SFRP1, SFRР2, SFRP5 и SFRP4 имелось у 41, 31, 22 и 4% больных соответственно. Авторами установлена ассоциация статуса метилирования SFRP5 с резистентностью к химиотерапии (р=0,015) и снижением безрецидивной выживаемости у больных в возрасте 60 лет и моложе с промежуточным кариотипом.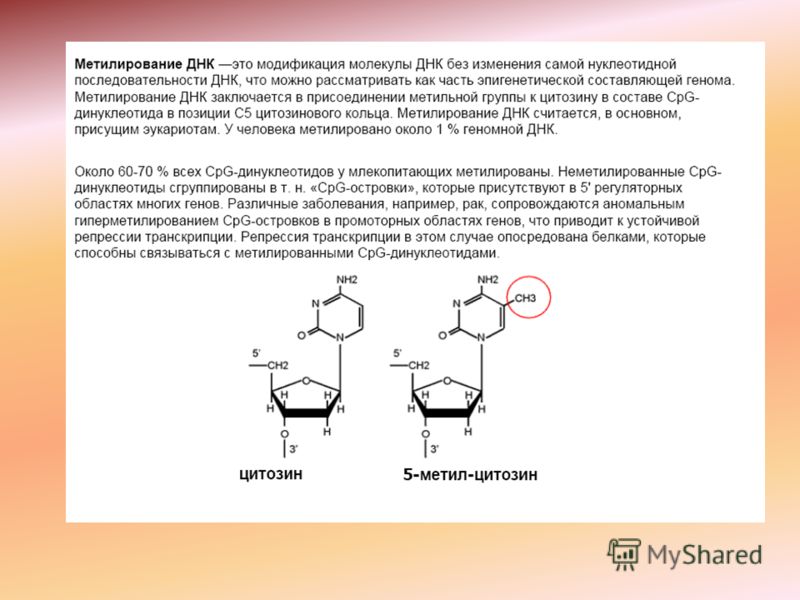 H. Hou и соавт. [8] обнаружили ассоциацию частоты метилирования ингибиторов Wnt с хромосомными аберрациями (р=0,0034), но при этом не подтвердили сопряженности аберрантного статуса с эффективностью лечения. Напротив, Е. Jost и соавт. [5] установили низкую выживаемость больных с вариантами CBF ОМЛ с метилированием гена SFRP2 (р=0,003), а Е. Griffiths и соавт. [7] выявили ассоциацию между АМ этого гена и высоким риском смерти больных, имеющих нормальный кариотип.
H. Hou и соавт. [8] обнаружили ассоциацию частоты метилирования ингибиторов Wnt с хромосомными аберрациями (р=0,0034), но при этом не подтвердили сопряженности аберрантного статуса с эффективностью лечения. Напротив, Е. Jost и соавт. [5] установили низкую выживаемость больных с вариантами CBF ОМЛ с метилированием гена SFRP2 (р=0,003), а Е. Griffiths и соавт. [7] выявили ассоциацию между АМ этого гена и высоким риском смерти больных, имеющих нормальный кариотип.
Учитывая противоречивый характер результатов предшествующих исследований и небольшое число собственных наблюдений, при анализе полученных данных мы уделили особое внимание распространенности аберрантного статуса метилирования изученных генов и их ассоциации с клинико-гематологическими показателями. В итоге установлено, что АМ 3—5 генов являются преимущественной находкой у больных ОМЛ с миелодисплазией или с комплексным кариотипом. Это позволяет прогнозировать низкую эффективность монотерапии гипометилирующими препаратами у больных этой категории. Основанием для такого предположения является сообщение M. Abaigar и соавт. [11], которые при многофакторном анализе результатов лечения 63 больных ОМЛ и миелодиспластическим синдромом с медианой возраста 69 лет установили снижение общей выживаемости (ОВ) в случае лейкоцитоза ≥15,0·109/л (р=0,033), содержания гемоглобина <100 г/л (р=0,029) и числа метилированных генов ≥2 (р=0,022). При этом необходимо отметить, что авторы не выявили сопряженности числа метилированных генов с ответом на 5-азацитидин.
Основанием для такого предположения является сообщение M. Abaigar и соавт. [11], которые при многофакторном анализе результатов лечения 63 больных ОМЛ и миелодиспластическим синдромом с медианой возраста 69 лет установили снижение общей выживаемости (ОВ) в случае лейкоцитоза ≥15,0·109/л (р=0,033), содержания гемоглобина <100 г/л (р=0,029) и числа метилированных генов ≥2 (р=0,022). При этом необходимо отметить, что авторы не выявили сопряженности числа метилированных генов с ответом на 5-азацитидин.
Совокупный анализ собственных находок с данными литературы, в частности о реэкспрессии гена p15INK4b и антагонистов сигнального пути Wnt in vitro при добавлении 5-азацитидина к культуре лейкозных клеток [5, 6, 24], делает обоснованным назначение больным ОМЛ с миелодисплазией или комплексным кариотипом 5-азацитидина в комбинации с цитостатиками [12, 13]. В настоящее время увеличивается число сообщений о модификации терапии 5-азацитидином у больных с миелоидными неоплазиями. Так, G. Borthakur и соавт. [12] приводят результаты одновременного назначения 5-азацитидина и цитарабина. Доза 5-азацитидина варьирует от 37,5 до 75 мг/м2 и вводится внутривенно однократно в течение последовательных 7 дней. Цитарабин назначается по 100 мг/м2 внутривенной суточной инфузией в течение 7 дней или по 1 г/м2 в виде внутривенной суточной инфузии в течение 4 или 3 дней (последняя доза использована у больных 65 лет и старше). Полная ремиссия констатирована у 2 из 34 больных, один из которых имел комплексный кариотип, а другой — мутацию FLT3-ITD. Необходимо отметить крайне неблагоприятный прогноз у больных в данном исследовании: 94% имели рецидив или резистентный вариант. При этом случаев негематологической токсичности IV степени не зафиксировано.
Так, G. Borthakur и соавт. [12] приводят результаты одновременного назначения 5-азацитидина и цитарабина. Доза 5-азацитидина варьирует от 37,5 до 75 мг/м2 и вводится внутривенно однократно в течение последовательных 7 дней. Цитарабин назначается по 100 мг/м2 внутривенной суточной инфузией в течение 7 дней или по 1 г/м2 в виде внутривенной суточной инфузии в течение 4 или 3 дней (последняя доза использована у больных 65 лет и старше). Полная ремиссия констатирована у 2 из 34 больных, один из которых имел комплексный кариотип, а другой — мутацию FLT3-ITD. Необходимо отметить крайне неблагоприятный прогноз у больных в данном исследовании: 94% имели рецидив или резистентный вариант. При этом случаев негематологической токсичности IV степени не зафиксировано.
Возможен и другой вариант комбинированной терапии, предполагающий последовательное введение препаратов. U. Krug и соавт. [13] ранее не леченным больным ОМЛ в возрасте ≥61 года перед стандартным индукционным курсом 7+3 в течение 5 дней вводили 5-азацитидин по 37,5 или 75 мг/м2. В гематологической клинике РосНИИГТ инициировано пилотное клиническое исследование схемы, предполагающей последовательное введение 5-азацитидина в стандартной дозе (75 мг/м2 подкожно в 1—7-й день) и малых доз цитарабина (20 мг/м2 подкожно однократно в день на 8—14-й день). Данную схему планируется назначать больным ОМЛ с миелодисплазией или комплексным кариотипом после завершения первых двух курсов монотерапии 5-азацитидином.
В гематологической клинике РосНИИГТ инициировано пилотное клиническое исследование схемы, предполагающей последовательное введение 5-азацитидина в стандартной дозе (75 мг/м2 подкожно в 1—7-й день) и малых доз цитарабина (20 мг/м2 подкожно однократно в день на 8—14-й день). Данную схему планируется назначать больным ОМЛ с миелодисплазией или комплексным кариотипом после завершения первых двух курсов монотерапии 5-азацитидином.
Для оценки прогностической значимости аберрантного статуса метилирования отобраны больные ОМЛ с нормальным кариотипом и не имеющие мутаций в генах FLT3 и NPM1. Это обусловлено выраженной клинической вариабельностью течения заболевания у лиц указанной группы, когда выбор интенсивности постремиссионной терапии затруднителен и, следовательно, актуальным представляется поиск новых прогностических факторов. Сопряженности показателей ОВ и/или безрецидивной выживаемости с числом метилированных генов не выявлено. Тем не менее не исключено, что информативной может оказаться динамика статуса метилирования при проведении первых курсов терапии 5-азацитидином.
Заключение
АМ генов p15INK4b, SOX7 и антагонистов сигнального пути Wnt обнаруживается у большинства больных ОМЛ, что позволяет рекомендовать гипометилирующие препараты для лечения больных, которым по разным причинам не может быть назначена интенсивная цитостатическая терапия. Обнаружение у большинства больных ОМЛ с миелодисплазией или комплексным кариотипом значительного числа генов с аберрантным статусом метилирования служит основанием для инициации пилотного исследования по оценке эффективности комбинации 5-азацитидина с малыми дозами цитарабина. Число гиперметилированных генов не может использоваться как предиктор эффективности лечения больных ОМЛ с нормальным кариотипом и без мутаций в генах FLT3 и NPM1 с применением стандартных схем индукционной терапии.
Конфликт интересов отсутствует.
Витамины, метилирование ДНК и биологические часы — Новости
Узнать бы, сколько еще натикает.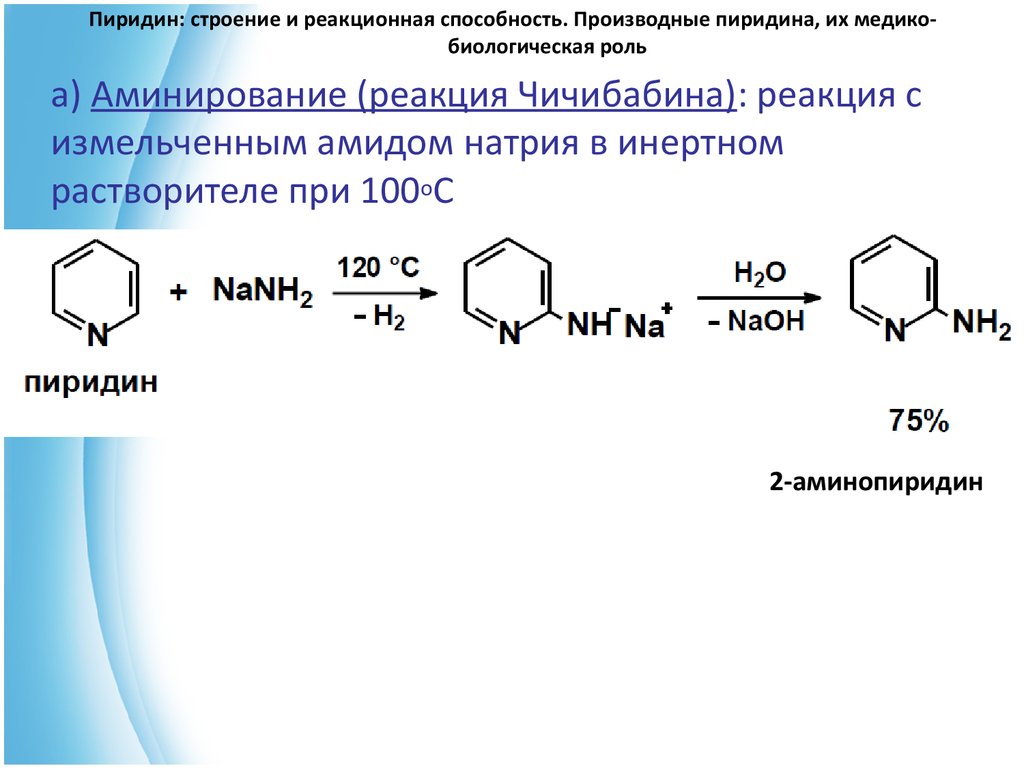 ..
..
«Биохакинг» – такой термин вы наверняка слышали. Хотя, если быть точным, это вовсе не термин, а очередной интернет-жаргонизм. Звучит ново и весело, тема более чем актуальная, но что дальше? А дальше ничего, кроме разглагольствований про тот же самый ЗОЖ, но только не в скучный фас, а в модный профиль.
Помните, в фильме «День сурка» хозяйка деревенской гостиницы спрашивает у заезжей звезды, что ведет выпуск метеоновостей на одном из центральных каналов, о том, какая будет погода? «Мэм, вы серьезно хотите поговорить о погодных явлениях или просто поболтать?» – отвечает тот. Так вот, биохакинг – это если поболтать. Во всех других случаях лучше обратиться к науке.
Эпигенетика. Чем не биохакинг?
Эпигенетика изучает любые явления и факторы (будь то внутри нас или в окружающей нас среде), которые изменяют в лучшую или худшую сторону тот генетический аппарат, который нам достался от природы.
Если раньше считалось, что наши гены – это константа, то сегодня ученые знают, что на протяжении жизни под влиянием внутренних и внешних воздействий структура и качество ДНК могут сильно меняться. Особенно ярко это было показано на примере однояйцевых близнецов, которые при рождении обладают абсолютно идентичными геномами, но к пожилому возрасту их ДНК могут быть все более и более непохожими друг на друга.
Особенно ярко это было показано на примере однояйцевых близнецов, которые при рождении обладают абсолютно идентичными геномами, но к пожилому возрасту их ДНК могут быть все более и более непохожими друг на друга.
Метилирование ДНК
Взять, например, такой показатель функционального состояния ДНК, как метилирование ее структурных единиц – нуклеотидов. Как было показано в исследовании M. Fraga (Proc Natl Acad Sci USA, 2005;102:10604-09), если у близнецов в возрасте трех лет доля метилированных нуклеотидов в составе ДНК почти одинакова, то у близнецов в возрасте 50 лет этот показатель может отличаться на 30–40%.
Стоп! Метилирование ДНК – это что? Попробую объяснить в двух словах. Нашу ДНК можно представить в виде… Ну, например, в виде печатной формы, в которую наборщик закладывает кучу буквенных штампов, после чего делается оттиск газетной страницы. Отдельных букв тут, как вы понимаете, очень много, и поэтому важно не ошибиться.
Чем более пожилым становится наборщик, чем больше изнашиваются буквенные штампы, чем больше туда попадает посторонних штампов (например, из других печатных изданий), тем выше вероятность опечаток и дефектов печати в газетном оттиске.
Здоровая ДНК – стабильная ДНК
Наша ДНК – это тоже набор разных штампов, которые называются генами. Только их в десятки тысяч раз больше, чем в любой газетной форме, и печать идет беспрерывно. Понятно, что накопление ошибок и дефектов при этом – вещь абсолютно неизбежная.
В ДНК могут появляться дефектные гены, «беглые» гены (перескакивающие из других ДНК), чуждые гены (этим грешат все вирусы, пытающие встроить свой генный материал в нашу ДНК). Все это ведет к нестабильности ДНК и ухудшению качества воспроизводимых по этой матрице клеточных структур.
Само собой, природа должна была что-то придумать для защиты от этих неприятных сюрпризов. И поскольку этот защитный механизм появился очень и очень давно (нас на Земле еще и в помине не было), он крайне прост. Стоит только появиться подозрительному гену, как наш организм «выключает» его, присоединяя к его молекулам метильную группу (соединение из одного атома углерода и трех атомов водорода).
Стоит только появиться подозрительному гену, как наш организм «выключает» его, присоединяя к его молекулам метильную группу (соединение из одного атома углерода и трех атомов водорода).
Собственно, это и есть метилирование ДНК. Благодаря такой простой химической трансформации отдельных дефектных генов мы их намертво блокируем и защищаем себя от того опасного генетического мусора, который они могли бы наплодить.
Понятно, что такое объяснение на пальцах – крайне упрощенная картинка очень сложного процесса. В нашей ДНК разные участки и разные гены могут диаметрально отличаться по степени метилирования, а некоторые по природе своей вообще никогда не метилируются. Однако, если не вдаваться в исключительно сложные подробности, можно сказать, что в целом чем ниже степень метилирования ДНК с возрастом, тем выше риск многих дегенеративных процессов и хронических заболеваний.
Метилирование ДНК и биологические часы
Зависимость между степенью метилирования ДНК и развитием болезней, приводящих в итоге к смерти, настолько точна, что на основании этого параметра была разработана модель биологических часов (S. Horvath, Genome Biol 2015, May 13;16(1):96).
Horvath, Genome Biol 2015, May 13;16(1):96).
Тут, само собой, возникает вопрос: почему с возрастом эффективность метилирования, а значит, и степень защиты ДНК, может снижаться? Ну, во-первых, не только с возрастом – есть много факторов, вмешивающихся в нормальный процесс метилирования ДНК независимо от паспортных данных. Например, тяжелые металлы, этиловый спирт, стресс, токсины, вызывающие активацию окислительных процессов в организме, и т. д.
Однако с возрастом к действию этих факторов добавляются уже сугубо специфические вещи, резко ухудшающие общую картину. Например, возрастное снижение уровня половых гормонов (особенно эстрогенов) значительно замедляет общую активность реакций метилирования в организме.
Кроме того, с возрастом происходит снижение эффективности обмена многих регуляторных веществ, включая фолиевую кислоту (витамин В₉) и витамин В₁₂, которые играют ключевую роль в реакциях метилирования в целом и метилирования ДНК в частности.
Можно ли замедлить биологические часы?
Вообще-то, точные и, главное, проверенные рекомендации вы вряд ли найдете. Дело в том, что сама по себе тема эпигенетики (а уж тем более тема измерения уровня метилирования ДНК в качестве биологических часов) еще очень новая.
Дело в том, что сама по себе тема эпигенетики (а уж тем более тема измерения уровня метилирования ДНК в качестве биологических часов) еще очень новая.
Тем не менее одно можно сказать точно: нарушение обмена или дефицит фолиевой кислоты, витамина В₁₂ (и в меньшей степени витамина В₆ и бетаина) однозначно нарушают обмен аминокислоты метионина, в результате которого и образуются те самые метильные группы, которые необходимы для метилирования ДНК.
Просто витамины?! Ну а гомоцистеин?
Взять, к примеру, такой хорошо изученный вопрос, как возрастное повышение уровня гомоцистеина в крови. Напомню: гомоцистеин – это промежуточный продукт обмена метионина, и этот самый гомоцистеин при избыточном накоплении в крови может существенно повышать риск сердечно-сосудистых болезней (почти как холестерин).
Так вот, сегодня ни у кого не вызывает вопроса необходимость дополнительного приема перечисленных выше витаминов в высоких дозах для нормализации обмена метионина и снижения уровня гомоцистеина.
А между тем гомоцистеин это лишь верхушка айсберга, указывающая на глубокое нарушение обмена метионина с большим количеством других неприятных последствий, включая то же самое метилирование ДНК.
В общем, мы еще очень многого не понимаем в эпигенетике и процессах метилирования ДНК, но как минимум поддержание адекватного уровня фолиевой кислоты, витаминов В₁₂ и В₆ (и, возможно, бетаина) здесь крайне важно. Особенно с учетом того, что именно с возрастом обмен этих витаминов начинает сильно страдать.
этилирование является допустимым английским словом
Срок действия Эрудита:
действительный (
международный — Соуподс
),
инвалид (
США — Twl06
)
Действительность iScramble:
инвалид
Срок действия QuickWords
:
инвалид
Значения
Существительное
(ИСЧИСЛЯЕМОЕ)
| Единственное число | Множественное число |
|---|---|
| этилирование | этилирование |
- (органическая химия) Любая реакция, которая вводит этильную группу в молекулу
этилирование
это
Scrabble действительное слово
этилирование
- Международный английский (Sowpods) — Слово
действует в Scrabble ✔
- Английский (США) (TWL06) — Слово
недействителен в Scrabble ✘
- n точек
этилирование
- Слово
недействителен в iScramble ✘
- Слово
недействителен в QuickWords ✘
- n точек
Реклама
Однобуквенные слова (анаграммы)
- нет
Те же буквы плюс одна
- ЭТИЛЯЦИИ
- МЕТИЛИРОВАНИЕ
Те же буквы минус одна
- АНТОЛИТ
- АНТИОТЕЛЬ
- ЛИТОНАТ
Что такое эпигенетика? | CDC
Ваши гены играют важную роль в вашем здоровье, но не меньшее значение имеют ваше поведение и окружающая среда, например, что вы едите и насколько вы физически активны. Эпигенетика — это исследование того, как ваше поведение и окружающая среда могут вызывать изменения, влияющие на работу ваших генов. В отличие от генетических изменений, эпигенетические изменения обратимы и не меняют последовательность вашей ДНК, но они могут изменить то, как ваше тело читает последовательность ДНК.
Эпигенетика — это исследование того, как ваше поведение и окружающая среда могут вызывать изменения, влияющие на работу ваших генов. В отличие от генетических изменений, эпигенетические изменения обратимы и не меняют последовательность вашей ДНК, но они могут изменить то, как ваше тело читает последовательность ДНК.
Экспрессия генов относится к тому, как часто или когда белки создаются в соответствии с инструкциями ваших генов. В то время как генетические изменения могут изменить состав белка, эпигенетические изменения влияют на экспрессию генов, включая и выключая гены. Поскольку ваше окружение и поведение, такое как диета и физические упражнения, могут привести к эпигенетическим изменениям, легко увидеть связь между вашими генами, вашим поведением и окружающей средой.
Как работает эпигенетика?
Эпигенетические изменения по-разному влияют на экспрессию генов. Типы эпигенетических изменений включают:
Метилирование ДНК
Метилирование ДНК работает путем добавления химической группы к ДНК. Как правило, эта группа добавляется в определенные места ДНК, где она блокирует белки, которые прикрепляются к ДНК, чтобы «читать» ген. Эта химическая группа может быть удалена с помощью процесса, называемого деметилированием. Как правило, метилирование «выключает» гены, а деметилирование «включает» гены.
Как правило, эта группа добавляется в определенные места ДНК, где она блокирует белки, которые прикрепляются к ДНК, чтобы «читать» ген. Эта химическая группа может быть удалена с помощью процесса, называемого деметилированием. Как правило, метилирование «выключает» гены, а деметилирование «включает» гены.
Модификация гистонов
ДНК оборачивается вокруг белков, называемых гистонами. Когда гистоны плотно упакованы вместе, белки, которые «считывают» ген, не могут так же легко получить доступ к ДНК, поэтому ген «выключается». Когда гистоны упакованы неплотно, больше ДНК открыто или не обернуто вокруг гистона, и к ним могут получить доступ белки, которые «считывают» ген, поэтому ген «включается». Химические группы могут быть добавлены или удалены из гистонов, чтобы сделать гистоны более плотно или рыхло упакованными, включая или выключая гены.
Некодирующая РНК
Ваша ДНК используется в качестве инструкции по созданию кодирующей и некодирующей РНК. Кодирующая РНК используется для производства белков. Некодирующая РНК помогает контролировать экспрессию генов, присоединяясь к кодирующей РНК вместе с определенными белками, чтобы разрушить кодирующую РНК, чтобы ее нельзя было использовать для создания белков. Некодирующие РНК могут также привлекать белки для модификации гистонов, чтобы включать или выключать гены.
Некодирующая РНК помогает контролировать экспрессию генов, присоединяясь к кодирующей РНК вместе с определенными белками, чтобы разрушить кодирующую РНК, чтобы ее нельзя было использовать для создания белков. Некодирующие РНК могут также привлекать белки для модификации гистонов, чтобы включать или выключать гены.
Как может измениться ваша эпигенетика?
Ваша эпигенетика меняется с возрастом, как в рамках нормального развития и старения, так и в ответ на ваше поведение и окружающую среду.
- Эпигенетика и развитие
Эпигенетические изменения начинаются еще до вашего рождения. Все ваши клетки имеют одни и те же гены, но выглядят и действуют по-разному. По мере вашего роста и развития эпигенетика помогает определить, какую функцию будет выполнять клетка, например, станет ли она клеткой сердца, нервной клеткой или клеткой кожи.
Пример: нервная клетка против мышечной клетки
Ваши мышечные и нервные клетки имеют одинаковую ДНК, но работают по-разному. Нервная клетка передает информацию другим клеткам вашего тела. Мышечная клетка имеет структуру, которая помогает вашему телу двигаться. Эпигенетика позволяет мышечной клетке «включать» гены, чтобы сделать белки важными для своей работы, и «выключать» гены, важные для работы нервной клетки.
Нервная клетка передает информацию другим клеткам вашего тела. Мышечная клетка имеет структуру, которая помогает вашему телу двигаться. Эпигенетика позволяет мышечной клетке «включать» гены, чтобы сделать белки важными для своей работы, и «выключать» гены, важные для работы нервной клетки.
- Эпигенетика и возраст
Эпигенетика меняется на протяжении всей жизни. Ваша эпигенетика при рождении отличается от вашей эпигенетики в детстве или взрослой жизни.
Пример: исследование новорожденных, 26-летних и 103-летних
Метилирование ДНК в миллионах участков было измерено у новорожденных, 26-летних и 103-летних. Уровень метилирования ДНК снижается с возрастом. У новорожденного был самый высокий уровень метилирования ДНК, у 103-летнего человека был самый низкий уровень метилирования ДНК, а у 26-летнего человека уровень метилирования ДНК был между новорожденным и 103-летним (1).
- Эпигенетика и обратимость
Не все эпигенетические изменения являются постоянными. Некоторые эпигенетические изменения могут быть добавлены или удалены в ответ на изменения в поведении или окружающей среде.
Некоторые эпигенетические изменения могут быть добавлены или удалены в ответ на изменения в поведении или окружающей среде.
Пример: Курильщики, некурящие и бывшие курильщики
Курение может привести к эпигенетическим изменениям. Например, в некоторых частях гена AHRR курильщики, как правило, имеют меньшее метилирование ДНК, чем некурящие. Разница больше для заядлых курильщиков и длительных курильщиков. После отказа от курения у бывших курильщиков может начаться повышенное метилирование ДНК в этом гене. В конце концов, они могут достичь уровня, аналогичного уровню некурящих. В некоторых случаях это может произойти менее чем за год, но продолжительность времени зависит от того, как долго и сколько человек курил до того, как бросить курить (2).
Эпигенетика и здоровье
Эпигенетические изменения могут по-разному влиять на ваше здоровье:
- Инфекции
Микробы могут изменить вашу эпигенетику, ослабив вашу иммунную систему. Это помогает микробу выжить.
Это помогает микробу выжить.
Пример: Mycobacterium tuberculosis
Mycobacterium tuberculosis вызывает туберкулез. Инфекции этими микробами могут вызывать изменения гистонов в некоторых ваших иммунных клетках, что приводит к «отключению» Ил-12В ген. «Выключение» гена IL-12B ослабляет вашу иммунную систему и повышает выживаемость Mycobacterium tuberculosis (3).
- Рак
Определенные мутации повышают вероятность развития рака. Точно так же некоторые эпигенетические изменения увеличивают риск развития рака. Например, наличие мутации в гене BRCA1 , которая мешает ему работать должным образом, повышает вероятность развития рака молочной железы и других видов рака. Точно так же повышенное метилирование ДНК приводит к уменьшению 9Экспрессия гена 0164 BRCA1 повышает риск развития рака молочной железы и других видов рака (4). В то время как раковые клетки имеют повышенное метилирование ДНК в определенных генах, общий уровень метилирования ДНК в раковых клетках ниже, чем в нормальных клетках. Различные типы рака, которые выглядят одинаково, могут иметь разные модели метилирования ДНК. Эпигенетика может использоваться, чтобы помочь определить, какой тип рака у человека, или может помочь обнаружить рак, который трудно обнаружить раньше. Эпигенетика сама по себе не может диагностировать рак, и рак должен быть подтвержден дальнейшими скрининговыми тестами.
Различные типы рака, которые выглядят одинаково, могут иметь разные модели метилирования ДНК. Эпигенетика может использоваться, чтобы помочь определить, какой тип рака у человека, или может помочь обнаружить рак, который трудно обнаружить раньше. Эпигенетика сама по себе не может диагностировать рак, и рак должен быть подтвержден дальнейшими скрининговыми тестами.
Пример: колоректальный рак
Колоректальный рак характеризуется аномальным метилированием участков ДНК рядом с определенными генами, что влияет на экспрессию этих генов. Некоторые коммерческие скрининговые тесты на колоректальный рак используют образцы стула для поиска аномальных уровней метилирования ДНК в одном или нескольких из этих участков ДНК. Важно знать, что если результат теста положительный или ненормальный, для завершения процесса скрининга необходимо провести колоноскопию (5).
- Питание во время беременности
Окружающая среда и поведение беременной женщины во время беременности, например, ест ли она здоровую пищу, могут изменить эпигенетику ребенка. Некоторые из этих изменений могут сохраняться десятилетиями и повышать вероятность развития у ребенка определенных заболеваний.
Некоторые из этих изменений могут сохраняться десятилетиями и повышать вероятность развития у ребенка определенных заболеваний.
Пример: голландский голод Зимний голод (1944-1945)
Люди, чьи матери были беременны ими во время голода, были более склонны к развитию определенных заболеваний, таких как сердечные заболевания, шизофрения и диабет 2 типа (6). Примерно через 60 лет после голода исследователи изучили уровни метилирования у людей, чьи матери были беременны ими во время голода. У этих людей было повышенное метилирование одних генов и пониженное метилирование других генов по сравнению с их братьями и сестрами, которые не подвергались голоду до своего рождения (7)(8)(9). Эти различия в метилировании могут помочь объяснить, почему у этих людей была повышенная вероятность развития определенных заболеваний в более позднем возрасте (6)(9)(10)(11).
- Learn.Genetics: Учебный центр генетических наук при Университете штата Юта
предоставляет подробное объяснение и интерактивный учебник по эпигенетике Институт наук об окружающей среде: эпигенетика
содержит информацию об эпигенетике, эпигенетических исследованиях и видео об эпигенетике.
 Proc Natl Acad Sci U S A 2012; 109:10522-7
Proc Natl Acad Sci U S A 2012; 109:10522-7 - Маккартни Д., Стивенсон А., Хиллари Р. и др., Эпигенетические признаки начала и прекращения курения. EBioMedicine 2018; 37:214-220
- Чандран А., Энтони С., Хосе Л. и др., Инфекция Mycobacterium Tuberculosis вызывает медикаментозное подавление экспрессии гена IL-12B в макрофагах с помощью HDAC1. Front Cell Infect Microbiol 2015; 5:90.
- Tang Q, Cheng J, Cao X и др., Метилирование ДНК в крови как биомаркер рака молочной железы: систематический обзор. Клин Эпигенетика 2016; 8: 115.
- Чан С.Х., Лян Д.К. Достижения в тестах для скрининга и диагностики колоректального рака. Expert Rev Mol Diagn 2022; 22: 449-460.
- Роузбум Т., Эпидемиологические данные об истоках здоровья и болезней, связанных с развитием: последствия пренатального недоедания у людей. J Эндокринол 2019. 242:T135-T144
- Heijmans B, Tobi E, Stein A, et al., Стойкие эпигенетические различия, связанные с внутриутробным воздействием голода у людей.

 Некоторые эпигенетические изменения могут быть добавлены или удалены в ответ на изменения в поведении или окружающей среде.
Некоторые эпигенетические изменения могут быть добавлены или удалены в ответ на изменения в поведении или окружающей среде. Это помогает микробу выжить.
Это помогает микробу выжить. Различные типы рака, которые выглядят одинаково, могут иметь разные модели метилирования ДНК. Эпигенетика может использоваться, чтобы помочь определить, какой тип рака у человека, или может помочь обнаружить рак, который трудно обнаружить раньше. Эпигенетика сама по себе не может диагностировать рак, и рак должен быть подтвержден дальнейшими скрининговыми тестами.
Различные типы рака, которые выглядят одинаково, могут иметь разные модели метилирования ДНК. Эпигенетика может использоваться, чтобы помочь определить, какой тип рака у человека, или может помочь обнаружить рак, который трудно обнаружить раньше. Эпигенетика сама по себе не может диагностировать рак, и рак должен быть подтвержден дальнейшими скрининговыми тестами. Некоторые из этих изменений могут сохраняться десятилетиями и повышать вероятность развития у ребенка определенных заболеваний.
Некоторые из этих изменений могут сохраняться десятилетиями и повышать вероятность развития у ребенка определенных заболеваний. Proc Natl Acad Sci U S A 2012; 109:10522-7
Proc Natl Acad Sci U S A 2012; 109:10522-7